Ван-дер-ваальсовая адсорбция
Cтраница 1
Теплоты ван-дер-ваальсовой адсорбции имеют тот же порядок величины, что и теплоты конденсации газов. Большая часть теорий ван-дер-ваальсовой адсорбции приписывает адсорбируемому веществу сходные с жидкостью свойства; согласно потенциальной теории, адсорбируемое вещество при низких температурах ведет себя, как сильно сжатая жидкость; теория капиллярной конденсации принимает, что молекулярные объемы и поверхностные натяжения адсорбированного вещества такие же, как и у объемной жидкости, а теория полимолекулярной адсорбции допускает, что адсорбированное вещество и жидкость имеют одни и те же характеристики испарения и конденсации. [1]
Для ван-дер-ваальсовой адсорбции характерна очень большая скорость адсорбции: молекулы газа адсорбируются немедленно, после того как они достигнут поверхности. [2]
Теплоты ван-дер-ваальсовой адсорбции имеют тот же порядок величины, что и теплоты конденсации газов. Большая часть теорий ван-дер-ваальсовой адсорбции приписывает адсорбируемому веществу сходные с жидкостью свойства; согласно потенциальной теории, адсорбируемое вещество дри низких температурах ведет себя, как сильно сжатая жидкость; теория капиллярной конденсации принимает, что молекулярные объемы и поверхностные натяжения адсорбированного вещества такие же, как и у объемной жидкости, а теория полимолекулярной адсорбции допускает, что адсорбированное вещество и жидкость имеют одни и те же характеристики испарения и конденсации. [3]
Для ван-дер-ваальсовой адсорбции характерна очень большая скорость адсорбции: молекулы газа адсорбируются немедленно, после того как они достигнут поверхности. [4]
 |
Адсорбция Zr95 из н. HNO3. [5] |
Увеличение ван-дер-ваальсовой адсорбции нейтральных комплексов циркония в связи с фторированием поверхности объясняется ее гидрофобизацией. [6]
Характерной особенностью ван-дер-ваальсовой адсорбции является то, что она приводит к удерживанию у поверхности адсорбента целых молекул, составные части которых не участвуют в создании ионной части скачка потенциала. Адсорбированные частицы при этом находятся в пределах жидкой фазы. [7]
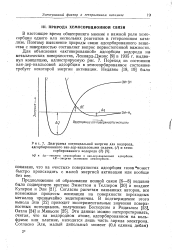 |
Диаграмма потенциальной энергии для водорода. [8] |
Переход из состояния ван-дер-ваальсовой адсорбции в хемосорбированное состояние требует некоторой энергии активации. [9]
Развитие теории теплоты ван-дер-ваальсовой адсорбции близко следовало за развитием теории ван-дер-ваальсовых сил. [10]
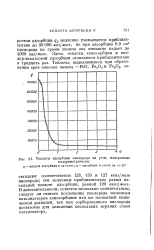 |
Теплоты адсорбции кислорода на угле, измеренные. [11] |
Здесь теплоты хемосорбции и ван-дер-ваальсовой адсорбции отличаются приблизительно в тридцать раз. [12]
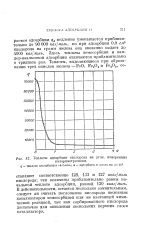 |
Теплоты адсорбции кислорода на угле, измеренныа. [13] |
Здесь теплоты хемосорбции и ван-дер-ваальсовой адсорбции отличаются приблизительно в тридцать раз. [14]
Таким образом, топлоты ван-дер-ваальсовой адсорбции аргона, азота, кислорода и окиси углерода на железе приблизительно равны между собой и лежат вблизи 4 ккал / молъ так же, как и для угля. Однако по отношению к хемосорбции все четыре газа проявляют резкое различие. Аргон не хемосорбируется; кислород, азот и окись углерода хемосорбируются с таким выделением тепла, которое приближается соответственно к теплотам образования окислов, нитридов и карбонила железа. [15]
Страницы: 1 2 3 4