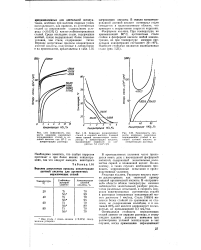
Возрастание - скорость - коррозия
Cтраница 2
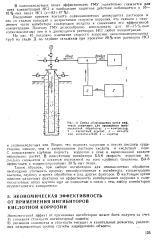 |
Схема оборудования устья иеф-тяиой скважины для проведения пеио кислотной обработки. / - компрессор, 2 - кислотный агрегат, 3 - емкость цля кислоты ПАВ, 4 - аэратор. [16] |
Увеличение времени контакта солянокислотных движущихся растворов и пен со сталью приводит к возрастанию скорости коррозии, что связано с окислением части ингибитора кислородом воздуха и снижением его эффективной концентрации. Поэтому ГМУ целесообразно использовать для 10 - 15 % - ных солянокислотных пен и в движущихся растворах НС1 любой концентрации. [17]
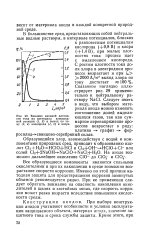 |
Влияние анодной плотности тока на потенциал электродной реакции ( /, 2 я выход по току ( 3, 4 кислорода ( /, 3 и хлора. [18] |
Все образующиеся компоненты являются сильными окислителями и при их накоплении в среде возможно возрастание скорости коррозии. Именно по этой причине катодная защита для предотвращения коррозии замкнутых объемов рекомендуется редко. При ее применении следует обратить внимание на опасность накопления окислителей в щелях и застойных зонах, где скорость коррозии может резко возрасти вследствие повышения кислотности среды. [19]
В соответствии с анодной поляризационной кривой смещение потенциала стали в положительную сторону сопровождается некоторым возрастанием скорости коррозии. Однако, поскольку сталь останется в пассивном состоянии, возрастание это невелико. Удельная активность раствора составляла 0 3 - 1 0 кюри / мл, а-излучение лишь в слабой степени увеличивает коррозию платины. Скорость коррозии циркония при наличии а-излучения увеличивается в 100 раз. Этот эффект связан с разложением бромисто-водородной кислоты, выделением атомарного брома и образованием перекиси водорода и других продуктов радиолиза. [20]
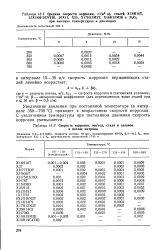 |
Средние скорости коррозии, г / ( м - ч, сталей Х18Н10Т.| Скорость коррозии, мм / год, стали и сплавов в потоке нитрина. [21] |
Увеличение давления при постоянной температуре ( в интервале 350 - 700 С) приводит к возрастанию скорости коррозии. С увеличением температуры при постоянном давлении скорость коррозии уменьшается. [22]
В сильно концентрированной азотной кислоте потенциал стали смещается в транспассивную область, что приводит к возрастанию скорости коррозии. [24]
Повышение концентрации Си ( П) в случае поддержания постоянного количества ионов хлора приводит к возрастанию скорости коррозии меди. Однако при некоторых соотношениях в электролите деполяризатора и лиганда наблюдается торможение коррозии, что приводит к появлению максимумов. [25]
При большом повышении анодного потенциала или окислительно-восстановительного потенциала среды у некоторых металлов, например Cr, Mo, Fe, Ni и др., наблюдается нарушение пассивности - перепассивация ( или транспассивность), которое приводит к возрастанию скорости коррозии. [26]
Таким образом, если при коррозии железа в кислых растворах по мере возрастания частоты при данной плотности фарадеевского тока происходит уменьшение скорости растворения железа [5], то в случае титана увеличение частоты при заданной плотности фарадеевского тока сопровождается, наоборот, возрастанием скорости коррозии. [27]
Одновременно с исчезновением фосфорной пленки, начинается интенсивное уменьшение сернистой пленки. При этом наблюдается вторичное возрастание скорости коррозии. [28]
Скорость коррозии в рассматриваемой системе определяется массопереносом веществ, вызывающих коррозию. Поэтому увеличение скорост / вращения образца вызывает возрастание скорости коррозии. При этом увеличивается и эрозия. Указанные процессы будут происходить и в буровом растворе без сероводорода, поскольку удалить кислород ( катодный деполяризатор) из такой сложной системы затруднительно. Наблюдаемое увеличение интенсивности коррозионко-эрозионных процессов связано также и с тем, что сероводород вызывает изменение реологических параметров буровых раотворов. [29]
Воды Северного моря, например, содержит 3 % хлорида натрия, 0 47 % сульфата магния, 0 2 % хлорида магния и 0 1 % хлорида кальция. Высокое содержание хлоридов должно было бы приводить к возрастанию скорости коррозии, которая в подобных условиях обычно носит питтинговый характер. [30]
Страницы: 1 2 3 4 5