Возрастание - скорость - коррозия
Cтраница 3
Если содержание СОг в смеси окиси этилена с аммиаком не превышает 0 15 %, стали Ст. Увеличение содержания СОг в исходной смеси приводит к возрастанию скорости коррозии углеродистых и низколегированных сталей. Так, в аммиачной воде при содержании СО2 около 10 % стали типа 2X13, 10Х13НБА нестойки. На образцах этих сталей обнаружены точечные поражения. [31]
Однако высокая устойчивость сплавов в указанных электролитах имеет место при положительных потенциалах. Смещение же потенциала системы к отрицательным значениям сопровождается возрастанием скорости коррозии, проходящей через максимум при - 100 же. [32]
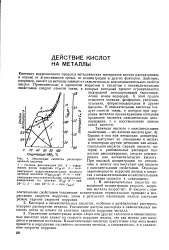 |
Некоторые свойства растворов азотной кислоты. [33] |
В неокислительных кислотах повышенной концентрации скорость коррозии металла возрастает. В кислоте с окислительными свойствами увеличение концентрации первоначально приводит к возрастанию скорости коррозии, затем в результате пассивации железа наступает резкое падение скорости коррозии. [34]
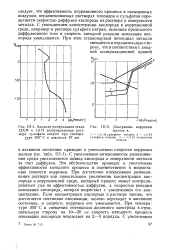 |
Анодная поляризация стали 12ХМ в 1ОН деаэрированном растворе сульфата натрия при температуре 300 С и давления 87 am.| Диаграммы коррозии железа в. [35] |
С увеличением интенсивности размешивания среды увеличивается подвод кислорода к поверхности металла за счет диффузии. Это обстоятельство приводит к увеличению эффективности катодного процесса и соответственно к возрастанию скорости коррозии. При достаточно интенсивном размешивании раствора или значительном увеличении концентрации кислорода в коррозионной среде, катодный процесс может контролироваться уже не эффективностью диффузии, а скоростью реакции ионизации кислорода, которая возрастает с увеличением его концентрации. Если концентрация кислорода в растворе такова, что достигается потенциал пассивации, железо переходит в пассивное состояние, и скорость коррозии его уменьшается. При температуре 300 С и смещении потенциала железного электрода в отрицательную сторону на 10 - 20 же скорость катодного процесса ионизации кислорода возрастает на 2 - 3 порядка. [36]
Рассмотрим, как влияет величина рН на скорость коррозии, протекающей с выделением водорода, и на коррозионное поведение некоторых металлов. Уменьшение рН ( увеличение концентрации Н - ионов) обычно приводит к возрастанию скорости коррозии прежде всего потому, что в кислой среде продукты коррозии ( окиси, соли) лучше растворимы и не создают помех для контакта металла со средой. Если в коррозии принимают участие макропары, то тогда увеличение концентрации Н способствует коррозии еще и потому, что приводит к значительному увеличению электропроводности среды. Примерами таких металлов могут служить алюминий, свинец, олово, цинк, хром и некоторые другие. [37]
Пластическая деформация увеличивает скорость растворения углеродистых, сталей [105] в серной и соляной кислотах. Увеличение степени наклепа стали, создаваемого, например, кручением проволоки также приводит к возрастанию скорости коррозии. [38]
Как видим, увеличение скорости коррозии цинка пропорционально перенапряжению выделения водорода ( константа а) на примеси, площадь которых примерно одинакова. Влияние величины площади поверхности, занятой катодными включениями, можно проиллюстрировать табл. 1 - 7, где показано возрастание скорости коррозии железа в кислоте с увеличением количества примесей. [39]
Если сопоставить данные, приведенные на фиг. Уменьшение скорости коррозии при рН, близком к 12, совпадает с резким увеличением времени до коррозионного растрескивания; возрастание скорости коррозии при рН, близком к 5, наоборот, сопровождается резким сокращением времени до коррозионного растрескивания. [40]
Как видим ( табл. 8), увеличение скорости коррозии цинка в зависимости от природы примеси пропорционально перенапряжению выделения водорода ( константе а) на примеси. Влияние величины площади поверхности, занятой катодными включениями, можно видеть из данных, приведенных в табл. 10, где показано возрастание скорости коррозии железа в кислоте с увеличением катодной площади, занимаемой в основном углеродом. [41]
На скорость коррозии оказывают влияние внутренние и внешние факторы. К внутренним факторам относятся химический состав и структура материала, состояние его поверхности, наличие напряжений и др., причем с увеличением неоднородности состава и структуры наблюдается возрастание скорости коррозии. В промышленной атмосфере, по данным многих исследований, скорость коррозии используемых материалов составляет в среднем 575 г / м2 в год. Ежегодные потери, например, США от коррозии оцениваются более чем в 100 млрд долл. [42]
Подобное поведение ограничивает применимость высокого парциального давления кислорода для уменьшения коррозии стали. При значительных концентрациях хлоридов ( например, в морской воде), железо вообще не пассивируется, поэтому в такой среде увеличение концентрации кислорода приводит лишь к возрастанию скорости коррозии. [43]
 |
Зависимость скорости коррозии сталей в смесях Н2 H2S от содержания H2S. [44] |
Следует обратить внимание на равновесную прямую, ниже которой сероводородная коррозия термодинамически невозможна. Выражать содержание H2S в величинах парциального давления удобнее, чем в объемных, весовых или мольных процентах, так как не требуется учитывать общее давление газовой смеси. Возрастание скорости коррозии с повышением содержания сероводорода происходит неравномерно: при малых концентра-циях H2S быстрее, а при более высоких - медленнее. [45]
Страницы: 1 2 3 4 5