Возрастание - скорость - коррозия
Cтраница 4
Попадая в зоны с низким содержанием кислорода ( под осадки песка и глины) и покрываясь осадками сульфида, они способны активизировать процесс суль-фатредукции и выделять сероводород. Присутствие активных форм сульфатвосстанавливающих бактерий в сточных и пластовых водах, содержащих сероводород, отмечено в настоящее время на нефтепромыслах Татарии, Башкирии, Куйбышевской, Пермской и Оренбург ской областей, Азербайджана и Западного Казахстана. Возрастание скорости коррозии стали в сточных водах может происходить также при наличии в них некоторого количества отработанных деэмульгаторов, особенно неионогенных, которые являются водорастворимыми поверхностно-активными веществами. Способствуя гидрофилизации внутренней поверхности и отмыву с нее нефти и смолистых отложений, они увеличивают площадь поверхности трубопроводов, подвергающейся интенсивному коррозионному разрушению. [46]
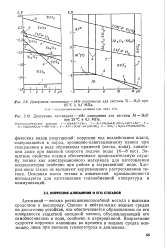 |
Диаграмма потенциал - рН равновесия для системы А1 - НгО. [47] |
Однако в нейтральных водных средах он достаточно устойчив, что обеспечивается образованием на его поверхности защитной оксидной пленки, обусловливающей его самопассивацию в воде, особенно в аэрированной. Возрастание скорости коррозии алюминия во времени в водных средах возможно лишь при высоких температурах и давлениях. [48]
 |
Схема процесса коррозии образца из стали Ст. 3 в двух несмешивающихся жидкостях. [49] |
Затемкоррозия несколько замедляется ( рис. 2), что связано, по-видимому, с образованием на металле тонкой и беспористой пленки сульфида железа, обладающей, как известно, небольшими защитными свойствами. После этого скорость разрушения металла вновь возрастает, в данном случае в результате развития коррозионного процесса в углеводородной фазе. При этом возрастание скорости коррозии совпадает по времени с образованием в этой части осадка сульфида железа. В двухфазной среде весовые потери ( до 90 - 95 %) происходят на поверхности образца углеродистой стали, где образовался нарост сульфида железа. После удаления продуктов коррозии обнаружен сильно корродированный металл с большим количеством разрушившихся пузырей наводороживания. [50]
 |
Схема процесса коррозии образца из стали Ст. 3 в двух несмешивающихся жидкостях. [51] |
Затем коррозия несколько замедляется ( рис. 2), что связано, по-видимому, с образованием на металле тонкой и беспористой пленки сульфида железа, обладающей, как известно, небольшими защитными свойствами. После этого скорость разрушения металла вновь возрастает, в данном случае в результате развития коррозионного процесса в углеводородной фазе. При этом возрастание скорости коррозии совпадает по времени с образованием в этой части осадка сульфида железа. В двухфазной среде весовые потери ( до 90 - 95 %) происходят на поверхности образца углеродистой стали, где образовался нарост сульфида железа. После удаления продуктов коррозии обнаружен сильно корродированный металл с большим количеством разрушившихся пузырей наводороживания. [52]
Как видно из таблицы, при плотностях тока I и 5 мА / см скорость коррозии стали выше, чем при плотностях 10, 20 и 50 мА / оЕ При первых двух значениях плотности тока потенциал стали I2XI8HIOT частично или в течение всего времени испытаний находится в области перепассивации ( см. рис. 2, кр. Дальнейшее увеличение плотности тока приводит к возрастанию скорости коррозии и в области выделения кислорода, хотя потенциал стали смещается незначительно ( см. рис. 2, кр. При всех значениях плотности тока, указанных в таблице, никель сохраняет стойкость. При 50 и 100 мА / см было отмечено некоторое увеличение массы образцов, связанное, очевидно с формированием окисла. [53]
 |
Характер зависимости скорости коррозии m ( потеря массы металла на 1 м2. [54] |
Чем больше-влажность, тем ближе грунт по свойствам приближается к чистому электролиту, тем меньше электрическое сопротивление грунта. Таким образом, можно сказать, что увеличение влажности способствует активизации анодного процесса, затрудняя одновременно протекание катодного процесса вследствие ухудшения воздухопроницаемости грунта. В соответствии с этим нельзя сказать, что любое увеличение влажности приводит к возрастанию скорости коррозии. На рис. 24.1 показана кривая зависимости скорости коррозии от влажности. [55]
Попадая в зоны с низким содержанием кислорода ( под осадки песка и глины) и покрываясь осадками сульфида, они способны активизировать процесс суль-фатредукции и выделять сероводород. Присутствие активных форм сульфатвосстанавливающих бактерий в сточных и пластовых водах, содержащих сероводород, отмечено в настоящее время на нефтепромыслах Татарии, Башкирии, Куйбышевской, Пермской и Оренбургской областей, Азербайджана и Западного Казахстана. Возрастание скорости коррозии стали в сточных водах может происходить также при наличии в них некоторого количества отработанных деэмульгаторов, особенно неионогенных, которые являются водорастворимыми поверхностно-активными веществами. Способствуя гидрофилизации внутренней поверхности и отмыву с нее нефти и смолистых отложений, они увеличивают площадь поверхности трубопроводов, подвергающейся интенсивному коррозионному разрушению. [56]
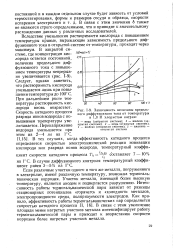 |
Зависимость величины предельного диффузионного тока от температуры в 1 0 Н хлористом натрии. [57] |
Если различные участки одного и того же металла, погруженного в электролит, имеют различную температуру, возможна термогальваническая коррозия. Участок металла, имеющий более высокую температуру, является анодом и подвергается разрушению. Интенсивность работы термогальванической пары зависит от разницы стационарных потенциалов горячего и холодного металлов, электропроводности среды, поляризуемости электродов. В связи с этим увеличение площади менее нагретых участков металла интенсифицирует работу термогальванической пары и приводит к возрастанию скорости коррозии более нагретых участков металла. [58]
Наличие щелей и зазоров сказывается на скорости коррозии аустенитной нержавеющей стали в воде при температуре 350 С ив перегретом паре при температуре 550 С. Зависимость скорости коррозии от величины зазора имеет сложный характер. С уменьшением величины зазора до 0 1 мм скорость коррозии также уменьшается. Дальнейшее уменьшение величины зазора до 0 05 мм приводит к возрастанию скорости коррозии - приблизительно в два раза по сравнению с ее скоростью в электролите. При плотном прилегании образцов скорость коррозии вновь снижается до величин, характерных для образцов, испытывавшихся вне щели. При этом следует заметить, что даже и в зазоре величиной 0 05 мм, где коррозия максимальна, абсолютная величина ее мала, и сталь я этих условиях достаточно. В зазоре величиной 0 05 мм она также максимальна - в четыре-пять раз больше, чем вне щели. Если образцы плотно прилегают друг к другу, а величина зазора 0 1 - 0 15 мм, скорость коррозии стали ЭИ-851 та же, что и вне щели ( 0 1 - 0 15 г / ж2 супг. [59]
Из таблицы видно, что потенциалы имеют более отрицательные значения и многие металлы, включая серебро, термодинамически неустойчивы в растворах, насыщенных воздухом, что вполне естественно, так как кислород является более сильным окислителем, чем ионы гидроксония. Однако кинетические торможения реакций растворения металла или восстановления окислителя могут сделать скорость коррозии чрезвычайно малой. Так, серебро все-таки оказывается довольно устойчивым в нейтральном водном растворе, насыщенном воздухом, если отсутствуют сульфиды. Наличие сульфидов вызывает смещение потенциала серебряного электрода в отрицательную сторону, что вызывает увеличение скорости реакции восстановления окислителя и, следовательно, возрастание скорости коррозии. [60]
Страницы: 1 2 3 4 5