Возрастание - адсорбция
Cтраница 1
 |
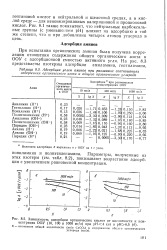
Распределение ионов у поверхности незаряженного электрода в растворе поверхностно-неактивного электролита. [1] |
Возрастание адсорбции в этом ряду частично связано со снижением энергии гидратации ионов по мере увеличения их радиуса. Менее гидратированные ионы получают возможность ближе подойти к поверхности, вследствие чего создаются условия для возникновения сил специфического взаимодействия анионов и металла. [2]
Возрастание адсорбции полидиметилсилоксана на окисленных сажах объясняется уменьшением адсорбции молекул гексана, что подтверждается результатами по адсорбции паров гексана на исходной и окисленной сажах. [3]
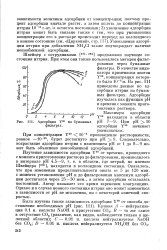 |
Адсорбция Y90 на бумажных фильтрах. [4] |
Следовательно, возрастание адсорбции иттрия с изменением рН от 1 до 8 - 9 может быть объяснено ионообменной адсорбцией. [5]
Уменьшение диэлектрической проницаемости растворителя приводит к возрастанию адсорбции кальция, что соответствует приведенным выше уравнениям. Увеличение константы обмена в пользу кальция обусловливается в основном снижением диэлектрической проницаемости среды. Кроме того, при переходе от воды к спиртам набухаемость ионитов снижается. Это усиливает кулоновское взаимодействие в ионите и способствует преимущественной адсорбции ионов кальция. [6]
Параметры, полученные из этих изотерм ( см. табл. 8.2), показывают возрастание адсорбции с увеличением равновесной концентрации. [8]
Для составных пористых сред, так же как и для единичных образцов, наблюдается возрастание адсорбции ОП-10 с уменьшением проницаемости пористой среды. Однако по абсолютной величине значения адсорбции ОП-10 при близких проницаемостях оказываются в среднем ниже, чем на единичных образцах. [9]
Так как величина Ь постоянна в гомологическом ряду, именно константа А определяет крутизну возрастания адсорбции с концентрацией; она получила поэтому название адсорбционной активности. [10]
 |
Изотермы поверхностного. [11] |
Так как величина Ь постоянна в гомологическом ряду, именно константа А определяет крутизну возрастания адсорбции с концентрацией и поэтому названа адсорбционной активностью. [12]
При исследовании кинетики прямого гидрогенолиза глюкозы [ 33 отмечено, что увеличение концентрации глюкозы в растворе сопровождается возрастанием адсорбции глюкозы на поверхности катализатора, и это может приводить к образованию кислот и отравлению катализатора, как и в случае водородного голодания. [13]
 |
Типы изотерм физической адсорбции паров. [14] |
Изотермы типа II и III сходны с изотермами типа IV и V, но две первые указывают на бесконечное возрастание адсорбции при приближении пара к насыщенному состоянию Р0, в то время как для последних двух типов изотерм максимум адсорбции почти достигается при давлениях PQ. Изотермы типа IV и V отвечают случаям, когда мономолекулярная и полимолекулярная адсорбция сопровождаются капиллярной конденсацией. [15]
Страницы: 1 2 3 4