Возрастание - адсорбция
Cтраница 3
Падение поверхностного натяжения при постоянстве адсорбции в соответствии с уравнением Гиббса связано только с ростом химического потенциала адсорбированного вещества при увеличении его концентрации в растворе. Поэтому в области концентраций, где поверхностное натяжение линейно зависит от логарифма концентрации, должно происходить, хотя и медленное, но конечное возрастание адсорбции, которое, однако, не фиксируется экспериментально. При этом малому увеличению адсорбции отвечает очень резкое возрастание химического потенциала молекул ПАВ в адсорбционном слое. Это позволяет отождествить свойства адсорбционных слоев - при достижении предельной адсорбции со свойствами конденсированной фазы при повышении давления: здесь также росту химического потенциала отвечают пренебрежимо малые изменения плотности. Эта аналогия, как будет показано далее при описании свойств адсорбционных слоев нерастворимых ПАВ, имеет глубокий физический смысл. [31]
На электросорбцию трипсина, кроме влияния кислотности среды, влияет взаимодействие заряженных форм белка с поляризованной поверхностью. Уменьшение адсорбционной емкости отрицательно заряженного сорбента определяется отталкиванием анионов белковой молекулы от одноименно заряженной поверхности. Возрастание адсорбции при увеличении положительного потенциала связано с процессом изменения структуры этого белка с основным. [32]
Кроме упомянутых выше факторов, существуют и некоторые другие. Например, орто-толилмочевина в 5 % - ной H2SO4 лучше ингибирует при повышенной температуре, чем при комнатной. Возможно, это происходит из-за возрастания адсорбции или вследствие того, что при повышенных температурах структура пленки получается более благоприятной. [33]
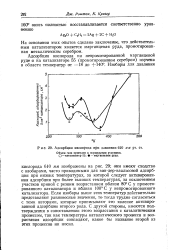 |
Адсорбция кислорода при давлении 610 мм рт. ст. [34] |
Если изобары выше этих температур действительно представляют равновесные значения, то тогда трудно согласиться с теми авторами, которые приписывают это явление активированной адсорбции второго рода. С другой стороны, имеются подтверждения в сопоставлении этого возрастания с каталитическим процессом, так как температуры каталитического процесса и возрастания адсорбции совпадают, какое бы название второй из этих процессов ни носил. [35]
Падение поверхностного натяжения при постоянстве адсорбции в соответствии с уравнением Гиббса связано только с ростом химического потенциала адсорбированного вещества при увеличении его концентрации в растворе. Как известно, рост химического потенциала в устойчивой двухкомпонентной системе всегда соответствует росту концентрации: в данном случае поверхностной концентрации, а следовательно, и адсорбции. Поэтому в области концентраций, где поверхностное натяжение линейно зависит от логарифма концентрации:, должно происходить, хотя и медленное, но конечное возрастание адсорбции, которое не фиксируется экспериментально. [36]
Лн от рН определяется видом изотермы адсорбции водорода и соотношением вкладов атома и иона в скачок потенциала. Увеличение энергии связи водорода и кислорода в щелочных средах является результатом ди-польного характера этих связей. Так как диполи водорода и кислорода обращены отрицательными концами к раствору ( для платины это верно при не слишком больших заполнениях поверхности Надс), то возрастание адсорбции катионов в щелочных средах должно приводить к упрочнению связи водорода и кислорода с поверхностью. [37]
На рис. I, 1 представлена зависимость количества адсорбированного газа Vr от температуры Т С - изобара рассмотренного процесса. Рассматривая процессы адсорбции этой системы, Тейлор предполагает, что в определенном интервале температур скорость процесса Ь будет мала по сравнению со скоростью процесса а. В этом случае результаты измерения будут соответствовать кривой а. В этой промежуточной стадии может наблюдаться возрастание адсорбции с ростом температуры. На рис. 1 1 эта область отмечена пунктиром. Поскольку адсорбция типа а является низкотемпературной и неспецифической, то для нее можно ожидать низких значений Qa. [38]
 |
Изменение скорости перемещения различных слоев жидкости в зависимости от их расстояния от стенки канала. [39] |
Если силы связи достаточно велики, адсорбированный атом останется у поверхности, если слабы - он может покинуть поверхность вещества. В последнем случае увеличение температуры, при которой протекает адсорбция, вследствие увеличения энергии тепловых колебаний адсорбированных частиц приводит к тому, что часть их возвращается в газовую среду и адсорбция уменьшается. Аналогично на развитие адсорбции влияет и уменьшение давления. Понижение температуры, наоборот, вызывает возрастание адсорбции, пока на поверхности не образуется тонкий слой газа в несколько молекулярных слоев. Так же влияет и увеличение давления. [40]
Как указывает сам Цименс [ Z14 ], значения ЕО и значения удельной поверхности являются ненадежными из-за наличия процесса отдачи косвенного действия. Резкое уменьшение вычисленных значений ЕО Для образцов, прокаленных при. Вычисленные значения ЕО, возможно, также слишком малы из-за возрастания адсорбции атомов инертного газа на поверхности образцов, прокаленных при более высокой температуре. [41]
Очень грубый расчет показывает, что экспериментальные данные Мак-Бэна и Бриттона находятся в согласии с потенциальной теорией. Так как Т 289 К, то разность равна 2350 кал. Поэтому и адсорбция должна быть при 60 am, по крайней мере, в три раза больше. И действительно, Мак-Бэн и Бриттон нашли для четырех различных образцов угля от 2 5 - до 7 2-кратное возрастание адсорбции. [42]
Иод, адсорбированный на поверхности CaF2, тоже обладает двумя максимумами, лежащими в зонах различных длин волн. При очень небольших степенях покрытия они соответствуют 284 и 343 mji. Первые адсорбированные молекулы отличаются очень высокими коэффициентами поглощения света, превышающими более чем в 100 раз соответствующее значение для паров свободного иода. После того как адсорбировано больше 0 5 % от насыщения, коэффициент поглощения внезапно падает настолько, что максимумы оказываются приблизительно равными максимумам поглощения для твердого иода; однако эти максимумы все еще сдвинуты в сторону более коротких волн. По мере возрастания адсорбции, максимумы смещаются в сторону больших длин волн. Особенно сильно смещается максимум, лежащий в области волн большой длины. Измерения, проведенные при возможно больших степенях адсорбции, показывают, что этот максимум делается очень слабым и похож на слабый максимум в области длинных волн, характерный для свободного иода. Возникающая связь довольно похожа на связь между молекулой иода и ионом иода в растворе. Наблюдаемый спектр действительно подобен спектру иона I 5, но это не может служить исчерпывающим разъяснением, так как остается непонятной причина внезапного резкого изменения после того, как адсорбировано лишь 0 5 % от количества, соответствующего насыщению. [43]
Очень грубый расчет показывает, что экспериментальные данные Мак-Бэна и Бриттона находятся в согласии с потенциальной теорией. По уравнению ( 13) потенциал s, соответствующий какому-либо определенному значению 5f - плотности в адсорбционном пространстве - при давлении в 1 am будет больше, чем при давлении в 60 am на величину RT n 60 кал. Так как Т 289 К, то разность равна 2350 кал. Поэтому и адсорбция должна быть при 60 am, по крайней мере, в три раза больше. И действительно, Мак-Бэн и Бриттон нашли для четырех различных образцов угля от 2 5 - до 7 2-кратное возрастание адсорбции. [44]
Увеличение задерживания Be с возрастанием рН не может быть объяснено наличием коллоидных агрегатов. Как показывают данные опытов по диффузии, средний радиус частиц Be7 порядка 1 - 2 тц, в то время как средний диаметр пор бумажных фильтров порядка микрона. Совпадение процента выделения Be7 из раствора при фильтровании и при центрифугировании также не может служить доказательством того, что Be7 образует в этих условиях коллоидные агрегаты, задерживающиеся на фильтре. Как видно из данных по центрифугированию, растворы Be7 полидисперсны: наряду с частицами, оседающими при ускорении в 25 000 g, имеются частицы, остающиеся в растворе. Можно себе представить, что оседающие частицы являются псевдоколлоидами, количество которых растет с увеличением рН, в то время как возрастание адсорбции Be7 на фильтрах обусловлено ионным обменом с активными карбоксильными группами. Уменьшение коэффициента диффузии Be7 также можно объяснить тем, что с возрастанием рН большая часть Be7 адсорбируется на загрязнениях. [45]
Страницы: 1 2 3 4