Электростатическая адсорбция
Cтраница 1
Электростатическая адсорбция представляет собой тот тип адсорбции, который рассматривается в теории Гуи - Чапма-иа. Понятно, конечно, что существует расстояние наибольшего сближения ионов с поверхностью металла и что в связи с этим следует принимать во внимание теорию Штерна. Принято и удобно термин адсорбция употреблять для остальных типов взаимодействия, и именно в этом смысле говорят, что ион фтора и одноатомные катионы не адсорбируются на ртути. [1]
Вторичная электростатическая адсорбция может быть идентифицирована по ее зависимости от концентрации потенциалобра-зующих ионов. В случае адсорбции ионов Еи3 на поверхности кристаллов BaS04 адсорбция увеличивается по мере возрастания отрицательного заряда поверхности, связанного с адсорбцией достаточно хорошо адсорбирующихся потенциалобразующих ионов SO. [2]
Правильнее полагать, что электростатическая адсорбция анионов ( при ф) 0) и катионов ( при ifi 0) приводят к различным значениям Спл. [3]
В излагаемой здесь теории электростатической адсорбции Ильина выдвинут принцип конкуренции молекул с жесткими электрическими моментами за место в поверхностном слое. [4]
Вторичная адсорбция обусловлена кулоновскими ( электростатическая адсорбция) или ван-дер-ваальсовыми ( молекулярная, или дисперсионная адсорбция) силами. [5]
Имеющиеся данные свидетельствуют о существенном влиянии электростатической адсорбции в поле двойного слоя на его свойства. В частности, увеличение емкости с ростом концентрации иодида в расплаве NaCl ( рис. 6) свидетельствует о поверхностной активности ионов I, которые, вероятно, способны вытеснять ионы С1 - из двойного слоя. Адсорбция, несомненно, приводит к перестройке структуры двойного слоя, к его сжатию. Однако детали этой перестройки пока не вполне ясны. Можно лишь предполагать, что для каждой соли характерна своя упаковка в двойном слое и что она в значительной степени определяется соотношением радиусов аниона и катиона. [6]
В первом случае ( D D0) электростатическая адсорбция ионов отрицательна, преобладают электрические силы отталкивания и диффузный двойной слой растянут по сравнению с двойным слоем по Гун. Напротив, при D та D0 преобладают электрические силы притяжения и диффузный двойной слой сжат по сравнению с двойным слоем по Гун. [7]
Причем при невысоких температурах ингибитор адсорбируется за счет электростатической адсорбции, с увеличением температуры физическая адсорбция переходит в химическую, дальнейшее повышение температуры приводит к десорбции ингибитора с поверхности корродирующего металла. С и возрастает с увеличением концентрации кислоты и ингибитора. [8]
Следует отметить, что изложенные представления учитывают лишь электростатическую адсорбцию, однако многие ингибиторы адсорбируются за счет специфической и химической адсорбции. При наличии тг-электронного взаимодействия между органическим веществом и поверхностью металла адсорбция возможна как при положительных, так и при отрицательных зарядах поверхности. [9]
Следует отметить, что изложенные представления учитывают лишь электростатическую адсорбцию, однако для многих ингибиторов характерна специфическая и химическая адсорбция. [10]
Так как в настоящем параграфе мы ограничиваемся расчетом эффектов электростатической адсорбции при явлении смачивания, то является невозможным непосредственное сравнение этого расчета с экспериментальной теплотой смачивания для сульфата кальция, если смачивание производится водой или метиловым спиртом, вследствие значительной растворимости CaS04 и химического взаимодействия. [11]
В рассмотренном примере возникновение двойного электрического слоя было обусловлено электростатической адсорбцией ионов. Предположим теперь, что в ячейке ( рис. 49) раствор NaF заменен раствором Nal, а напряжение от внешнего источника тока подобрано таким образом, что заряд поверхности ртути снова равен нулю. [12]
В рассмотренном примере возникновение двойного электрического слоя было обусловлено электростатической адсорбцией ионов. [13]
Таким образом, на границе электрод - раствор в результате электростатической адсорбции ионов возникает своеобразный микроконденсатор - двойной электрический слой, создающий разность потенциалов Лср. [14]
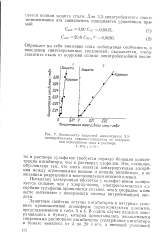 |
Зависимость защитной концентрации 3 5-динитробензоата гексаметпленимина от содержания агрессивного нона в растворе. / - so2. -. 2 - е. -. [15] |
Страницы: 1 2 3 4