Медленная адсорбция
Cтраница 1
Медленная адсорбция наблюдается на окислах, в особенности цинка, хрома и марганца. [1]
Обычно медленной адсорбции сопутствует и чрезвычайно медленная и трудная десорбция. [2]
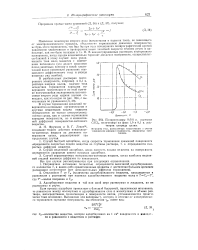 |
Подпрограммы 0 001 н. раствора CdCI2, полученные на фоне 1 0 и 0 1 н. растворов хлорида калия. [3] |
Случай медленной адсорбции, когда скорость подачи вещества на поверхность определяется скоростью самого процесса адсорбции. [4]
По температурной зависимости медленной адсорбции в указанной температурной области можно рассчитать число молекул водорода, ударяющихся о поверхность в 1 см2 за 1 час, равно как и соответствующую энергию активации. Тэйлор заключил отсюда, что молекулы газа сначала адсорбируются на поверхности и именно от нее получают требующуюся энергию активации. Так была обнаружена одна из интереснейших особенностей активированной адсорбции вскоре после открытия этого процесса Тэйлором. [5]
Аналогично во время медленной адсорбции антраценовых паров при 50 С на самой начальной стадии, когда поверхностное покрытие невелико и окраска только-только появляется, наблюдается сильный спектр ЭПР с прекрасным разрешением ( рис. 18), который размывается по мере того, как давление паров увеличивается. Одновременно с этим полосы поглощения смещаются и становятся шире в результате внутреннего взаимного возмущения и электронных переходов между ионизованными поверхностными структурами. [6]
Другим предельным случаем является медленная адсорбция вещества и быстрая химическая реакция на поверхности. Такой процесс называется химической адсорбцией или хемосорбцией. Здесь адсорбированные молекулы связываются с поверхностью химическими силами того же типа, что и силы, осуществляющие валентную связь. Для того чтобы эти силы действовали, молекула должна перейти в деформированное состояние и преодолеть активационный барьер. Поэтому химическая адсорбция требует энергии активации. Иногда ее называют активированной адсорбцией. Химическая адсорбция тесно связана с процессом гетерогенного катализа. [7]
Эта зависимость указывает на медленную адсорбцию или на реакцию поверхности кристалла с окружающей средой, приводящую к понижению сил адгезии. Изменение во времени краевого угла у капли ртути на некоторых кристаллических гранях в высоком вакууме позволяет сделать вывод об образовании адсорбционного и реакционного слоев, благодаря которым межфазная энергия понижается. [8]
 |
Значения TJ, t / s, r / slr s в растворах полиглицеридов концентрации 0 1 %. [9] |
Поэтому можно допустить, что медленная адсорбция при низких С раствора в ранней стадии насыщения слоя определяется медленной диффузией, при более же высоких С и, в особенности, в области С, соответствующих минимальному ар ( очевидно, выше ККМ), обусловлена энергетическим эффектом. Кроме того, ориентационный барьер связан с временем оптимальной упаковки молекул в адсорбционном слое и временем дегидратации некоторых частей молекул, которые могут быть не бесконечно малыми. [10]
Шейбле [16] полагает, что медленная адсорбция кислорода на никеле объясняется активированным перемещением хемосор-бированного адсорбата на новые адсорбционные центры металлической поверхности, и выводит логарифмическую зависимость кинетики этого процесса. Его данные не подтверждают механизм, основанный на диффузии кислорода в решетку металла. Портер и Томпкинс [17] показали, что в случае адсорбции водорода на железе медленным, определяющим скорость процессом является активированная миграция адсорбированных атомов к новым центрам, что делает доступными для адсорбции новые дополнительные центры. Эти авторы показали, что пары ртути вытесняют по крайней мере 95 % адсорбированного водорода, и, следовательно, газ должен находиться на поверхности, а не внутри металла. [11]
Эти опыты ясно показывают, что ранее наблюдавшаяся медленная адсорбция водорода на никелевых катализаторах представляет не адсорбцию, а сорбцию, состоящую из адсорбции и абсорбции водорода, причем последняя происходит в местах, не доступных для окиси углерода, криптона и быстрой адсорбции водорода при - 196 и не доступных также для этилена. [12]
Дженкинса-Ри - дила [173], предполагающий медленную адсорбцию водорода на неблокированных участках поверхности. [13]
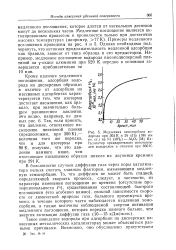 |
Медленная хемосорбция водорода при 303 К и 26 кПа ( 196 мм рт. ст. на Ni ( 30 % - А12О3. Катализатор предварительно восстановлен водородом и откачан при 660 К. [14] |
Однако необходимо подчеркнуть, что истинная продолжительность медленной адсорбции как правило, зависит от типа образца и его предыстории. Например, медленное поглощение водорода высокодисперсной платиной на - у-окиси алюминия при 520 К нередко в основном завершается приблизительно за 10 мин. [15]
Страницы: 1 2 3 4