Медленная адсорбция
Cтраница 2
Часто на границе раздела воздух - вода наблюдается сравнительно медленная адсорбция. До сих пор остается неясным, обусловлен ли медленный процесс электрическими потенциальными барьерами, или тем, что приближающаяся молекула, прежде чем она сможет внедриться в монослой, должна принять какую-то определенную ориентацию. [16]
В настоящее время известно, что наблюдаемые при медленной адсорбции величины скоростей на несколько порядков меньше числа молекул, которые соударяются в единицу времени с поверхностью и обладают энергией, равной или большей энергии активации, наблюдаемой в опытах. Для водорода величина Е незначительна ( во всяком случае при адсорбции металлами), а величина и пренебрежимо мала. Для окислов величина и может быть большой. Значение величины Е зависит, вообще говоря, от рода газа; для водорода при адсорбции его металлами и некоторыми окислами оно невелико, однако для других поверхностен, таких, например, как углерод, величина Е у. Для азота, метана и насыщенных углеводородов энергия активации, которой должны обладать молекулы газа для того, чтобы они могли быть адсорбированы металлическими пленками или техническими катализаторами, может достигать многих килокалорий. [17]
Возможен также и другой подход - можно рассматривать медленную адсорбцию как перетекание водорода на носитель, которое совершенно не вносит вклада в адсорбцию на металле. Следует отметить, что перетекание водорода - установленное явление. Оно наглядно проявляется при адсорбции водорода на катализаторах платина - углеродный носитель. Однако поверхностная подвижность адсорбированного кислорода значительно ниже, чем адсорбированного водорода, и в целом перетеканием адсорбированного кислорода в условиях, используемых при определении удельной поверхности металла по хемосорбции кислорода, можно пренебречь. [18]
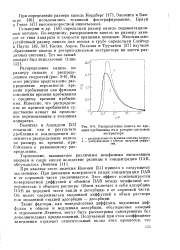 |
Распределение капель по времени пребывания их в роторно-дисковом экстракторе. [19] |
Такие факторы, как поверхностная диффузия, медленная диффузия в объеме и медленная адсорбция, обсуждаемые каждый в отдельности Левичем, могут быть рассмотрены одновременно без дополнительных предположений. [20]
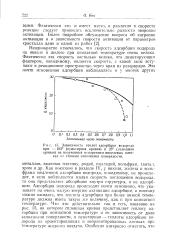 |
Зависимость теплот адсорбции водорода при - 183 ( пунктирная кривая и 23 ( сплошная кривая на полученных испарением никелевых пленках от степени заполнения поверхности. [21] |
Как показано в разделе IV, у никеля, железа и вольфрама медленной адсорбции водорода, повидимому, не происходит, и если наблюдается малая скорость поглощения водорода, то она представляет абсорбцию внутри структуры, а не адсорбцию. Адсорбция водорода происходит почти мгновенно, что указывает на очень малую энергию активации адсорбции, а поэтому можно ожидать, что теплота адсорбции при более низкой температуре должна иметь такую же величину, как и при комнатной температуре. Что это действительно так и есть, показано на рис. 15, на котором сплошная кривая представляет теплоту адсорбции при комнатной температуре и ее зависимость от доли заполнения поверхности, а пунктирная - теплоты адсорбции водорода на ориентированных и неориентированных пленках при температуре жидкого воздуха. [22]
Первый порядок реакции по отношению к NO в этом случае может быть обусловлен медленной адсорбцией окиси азота на поверхности катализатора. Такое предположение выдвинуто Винтером [280], исследовавшим разложение NO на сорока различных окислах в области температур 330 - 870 С. [23]
В тонких слоях крупных частиц, иными словами, для малых пузырей и при медленной адсорбции по сравнению с газообменом, газ А способен переходить в плотную фазу без значительного поглощения, так что концентрация А будет ловсюду одинаковой. [24]
Согласно Бику, процесс хемосорбции водорода на пленках металла протекает обычно весьма быстро, а медленная адсорбция, которая иногда наблюдается, приписывается вторичному эффекту проникания адсорбента, как уже отмечалось выше. На платиновой черни [11] по крайней мере 90 % поглощенного водорода адсорбируется очень быстро, поэтому величина удельной поверхности, рассчитанная из общего поглощения, была на 10 % выше. При адсорбции на палладии, как хорошо известно, водород проникает в глубь решетки, поэтому определение удельной поверхности этого металла по адсорбции водорода полностью исключено. [25]
Это кажущееся противоречие было устранено Дамкелером [91], показавшим, что экспериментальные данные по такой медленной адсорбции на древесном угле и силикагеле можно объяснить количественно, если предположить, что скорость процесса определяется скоростью диффузии через поры этих пористых адсорбентов. [26]
Это уравнение имеет такой же вид, что и уравнение, описывающее кинетику активации ZnO и медленной адсорбции на ZnO и NiO. Для понимания процесса дезактивации очень существенно, что стадии ( а) можно избежать, если предварительно обработать катализатор окисью углерода. После такой обработки при 106 С измеренные скорости каталитической реакции были очень близки к значениям, полученным на необработанном катализаторе после продолжительного употребления. По-видимому, свежий катализатор содержит избыточный кислород, обладающий высокой реакционной способностью и удаляемый из катализатора при прогревании последнего в окиси углерода или в процессе катализа. Это подтверждается тем фактом, что катализатор, прокаленный в гелии, вначале менее активен, чем катализатор, прокаленный на воздухе. [27]
Теперь рассмотрим, каковы будут кинетические изотопные эффекты по промежуточному и конечному продуктам реакции для случая медленной адсорбции водорода. [28]
Высокотемпературная адсорбция ( см., например, [33, 44]) обычно применяется с целью снижения до минимума собственной адсорбции водорода на носителе и ускорения медленной адсорбции. Однако примеров успешного определения удельной поверхности платины в дисперсных катализаторах по адсорбции водорода при 273 - 300 К ( например, [64-66, 69]) описано достаточно много, чтобы можно было сделать вывод, что высокая температура, в сущности, не является необходимой. [29]
Если скорость адсорбции мала и сравнима со скоростью химической реакции на поверхности, то кинетическое уравнение процесса имеет более сложный вид, В предельном случае очень медленной адсорбции скорость ее совпадает со скоростью процесса в целом. [30]
Страницы: 1 2 3 4