Диссоциация - кислота
Cтраница 3
При диссоциации кислот отличие состоит в том, что протон присоединяется к аниону диссоциирующей кислоты НА и к первой молекуле растворителя ковалентной связью. [31]
При диссоциации кислот не образуются какие-либо другие положительно заряженные ионы, кроме ионов водорода. [32]
При диссоциации кислот ионы водорода отщепляются постепенно, в результате чего остаются различные группы атомов - анионы, которые называются кислотными остатками. Например, Н РО4 образует три кислотных сс-татка. [33]
Поскольку диссоциация кислоты в воде есть работа, совершаемая против Н - связи, которой ион водорода соединен с анионом, сила кислоты будет уменьшаться по мере увеличения энергии ее Н - связей. [34]
При диссоциации кислоты и образовании аниона его электронное строение, а также сольватация могут очень сильно отличаться от тех же характеристик исходной молекулы, 4iO biiuoii иильшои вклад ь 1ермиди11амичесМ1с фчнкции процесса диссоциации. [35]
Константы диссоциации кислот равны: / Снсоон 1 77 - 10; / Сснзсоон 1 75 - ЮЛ Определите ЭДС цепи. [36]
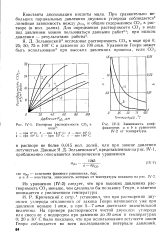 |
Изотермы растворимости СО2 в.| Зависимость коэффициентов а и b в уравнении IV-2 от температуры. [37] |
Константа диссоциации кислоты мала. [38]
Константы диссоциации кислот ( оснований) должны быть не менее Ю-7, так как скачок титрования существенно зависит от значения этих констаит. Растворы определяемых кислот и оснований не должны быть сильно разбавленными, так как скачок титрования зависит также от концентрации титруемой кислоты или основания ( см. разд. [39]
Механизм диссоциации кислот представлен на рис. 5.6: вокруг полярных молекул ориентируются диполи воды и в результате взаимодействия полярные молекулы превращаются в ионные, а последние - - в гидратированные ионы. [40]
Уравнения диссоциации кислот, а также диссоциацию воды следует писать, учитывая гидратацию иона водорода, например. [41]
Степень диссоциации кислоты с настолько малым значением Ка должна быть очень невелика. [42]
Степень диссоциации кислоты при переходе от водной среды к органической понижается на 4 - 6 порядков. [43]
Константы диссоциации кислот близки друг к другу и концентрации их равны друг другу. [44]
Константы диссоциации кислот резко отличаются друг эт друга, и концентрации кислот различны. Вычислим концентрацию ионов водорода и концентрацию каждого аниона в растворе, содержащем две кислоты, константы диссоциации которых резко отличаются друг от друга, при различной концентрации кислот. Обозначим концентрации кислот соответственно через СНА. [45]
Страницы: 1 2 3 4