Диссоциация - молекула - кислород
Cтраница 3
Большая скорость разложения озона по сравнению со скоростью его образования, повидимому, связана с тем, что для диссоциации молекулы кислорода необходима энергия - 5 эв, тогда как для распада озона достаточно - 1 эв. Этому же соответствуют и различия в) потенциалах ионизации, газокинетическом сечении и других характеристиках молекул озона и кислорода. [31]
Так, при скоростях обтекания воздухом, в шесть раз превышающими скорость звука, температура торможения оказывается достаточной, чтобы началась интенсивная диссоциация молекул кислорода ( см. введение и гл. [32]
Когда молекула N2 диссоциирует на атомы на поверхности металла или разлагается на атомы до адсорбции, то, как и в случае кислорода, можно ожидать сильного электронного взаимодействия между азотом и поверхностью металла. Однако процесс диссоциации молекул N2 протекает труднее, чем у молекул О2, поскольку энергия диссоциации молекул азота примерно вдвое превышает энергию диссоциации молекул кислорода. В этом случае с ростом покрытия поверхности энергия активации увеличивается с 1500 до 3800 кал. [33]
Озон ( 03) образуется в верхних слоях атмосферы под действием ультрафиолете вого света, излучаемого солнцем. Первой стадией образования озона является диссоциация молекулы кислорода на два атома кислорода; каждый из атомов кислорода после этого соединяется с молекулой кислорода и образует молекулу озона. Энергия диссоциации молекулы кислорода на атомы кислорода составляет 5 08 эв. [34]
 |
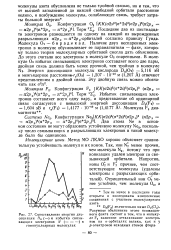
Энергетическая диаграмма и заселенность орбиталей электронами в молекуле кислорода ( а и оксида азота ( 2 ( б. [35] |
Молекулярный ион кислорода О2 ( диоксигенил-катион) по сравнению с молекулой кислорода имеет на один электрон меньше. И большая величина порядка связи и меньшее число электронов на РМО у О2 приводят к тому, что он прочней молекулы кислорода. Энергия диссоциации молекулы кислорода на атомы равна 497 кДж / моль, а для О2 она достигает значения 643 кДж / моль. Диоксигенил-катиону изоэлектронна гетероатомная молекула оксида азота ( 2) с энергией диссоциации на атомы 627 кДж / моль. Это еще одно убедительное доказательство того, что такие молекулы, как О2, NO и др., в принципе нельзя и, самое главное, не нужно пытаться интерпретировать с точки зрения МВС. Тогда отпадает необходимость прибегать к формальным представлениям о трехэлектронной связи. Таким образом, в ММО отчетливо проявляется принцип изоэлектронности, согласно которому молекулы с одинаковым числом электронов обладают аналогичной картиной заселенности МО и, следовательно, имеют сходную электронную структуру и близкие физико-химические характеристики. [36]
Впервые проблема тепловой защиты была сформулирована и получила интенсивное развитие в авиационно-космической технике в связи с решением задач гиперзвукового полета в атмосфере. При движении какого-либо тела со скоростями более чем в шесть раз превышающими скорость звука, в самом газовом потоке и на поверхности тела происходит целый ряд физико-химических превращений. В воздухе за ударной волной начинается диссоциация молекул кислорода, а затем и азота. На поверхности тела появляются очаги разрушения материала стенки. В тонком пристеночном слое выделяется тепловая энергия трения и происходит конвективный перенос тепла от газа к поверхности. [37]
Синтезу озона посвящено большое число работ. Установлено, что фотохимически активен только свет с Ж210 нм. При облучении светом с Я 175 нм происходит фото диссоциация молекулы кислорода на атомы. Причем каждый атом реагирует с молекулой кислорода, образуя озон с квантовым выходом, равным двум. [38]
С этой точки зрегогя начальным продуктом окисления в атмосфере кислорода, очевидно, должна быть не перекись, а спирт. Невидимому, однако, они являются лишь вторичными продуктами данной реакции. Одним из наиболее слабых мест гидроксилыюй теории является также требование предварительной диссоциации молекулы кислорода, что явно необходимо для образования гидроксила, но маловероятно с энергетической точки зрения. [39]
С этой точки зрения начальным продуктом окисления в атмосфере кислорода, очевидно, должна быть не перекись, а спирт. Повидимому, однако, они являются лишь вторичными продуктами данной реакции. Одним из наиболее слабых мест гпдрокешгыюй теории является также требование предварительной диссоциации молекулы кислорода, что ятю необходимо для образования гидроксила, но маловероятно с энергетической точки зрения. [40]
Так, например, Каллендар [28], излагая свои опыты по медленному горению различных углеводородов, отмечает, что ему ни разу. Кроме того, Каллендар указал также на то, что гидроксиляционная теория требует допущения предварительной диссоциации молекул кислорода на атомы, иначе непонятно, каким образом реагирует молекулярный кислород. [41]
На рис. 2 отчетливо видны три формы адсорбции кислорода. Проявляемый при этих измерениях сорбционный процесс фадс / фдес - 0 4 е / 0 05 в также можно охарактеризовать как адсорбцию с диссоциацией молекулы кислорода, идущую, однако, на участках с еще большей энергией связи, чем процесс при фадс / фдес - 0 55 е / 0 4 в. Указанную форму адсорбции кислорода нелегко обнаружить, так как это наиболее прочно связанный с поверхностью серебра кислород, являющийся как бы фоном, на котором протекают другие адсорбционные процессы кислорода. Только при глубокой катодной поляризации поверхность серебра может быть освобождена от этого кислорода и от кислорода, растворенного в приповерхностных слоях металла. [42]
Как указывалось ранее, в горючей смеси содержится избыток водорода ( 3 %), частично сжигаемый за счет кислорода, поступающего в печь с газами. Для расчета истинной теоретической температуры горения в этом случае необходимо учесть константы и теплоты образования воды из водорода и кислорода, диссоциации воды на водород и гидроксил, диссоциации молекул кислорода и азота, а также возможные реакции восстановления СО2 до СО и образования окиси азота. [43]
 |
Сопоставление энергии диссоциации. 00 ( - и избытка связывающих электронов N ( - - - - - - - - - - - в. [44] |
Последние два из шестнадцати электронов размещаются по одному на каждой из вырожденных разрыхляющих п2рх л 2ру - орбиталей согласно правилу Гунда. Наличие двух неспаренных электронов в молекуле обусловливает ее парамагнитизм - факт, которому только теория молекулярных орбиталей смогла дать объяснение. До этого считали все электроны в молекуле О2 спаренными. В молекуле О2 избыток связывающих электронов составляет всего две пары, двойная связь должна быть менее ррочной, чем тройная в молекуле Nz. Энергия диссоциации молекулы кислорода D0 ( O2) 5 116 эВ и межъядерное расстояние-ге ( О2) 1 207 10 - 10 м ( 1 207 А) отвечают представлениям о двойной связи. [45]
Страницы: 1 2 3 4