Диссоциация - растворенное вещество
Cтраница 1
Диссоциация растворенных веществ на ионы подчиняется тем же законам химического равновесия, что и другие реакции. Наличие зарядов у образовавшихся ионов конечно не отражается на применимости первого и второго законов термодинамики и всех следующих из них выводов. [1]
 |
Подвижность ионов в разбавленных водных растворах. [2] |
Диссоциация растворенного вещества на ионы подчиняется тем же законам химического равновесия, что и другие реакции. Процесс диссоциации на ионы обратим, а равновесие характеризуется константой диссоциации. В уравнениях равновесия, справедливых для идеальных растворов, константу диссоциации выражают через концентрации, а в реальных растворах - через активности. [3]
При диссоциации растворенного вещества появляются дополнительные силы взаимодействия между растворителем и растворенным веществом. [4]
Степень диссоциации растворенных веществ, как правило, значительно превышает степень диссоциации жидкости, поэтому последней часто пренебрегают. Такой раствор, насыщенный ионами и способный проводить электрический ток, называется электролитом. [5]
Степень диссоциации растворенного вещества должна быть рассчитана из / ( дис или определена в отдельном опыте. [6]
Константа диссоциации растворенного вещества АВ в разбавленном растворе равна К. [7]
Поэтому для диссоциации растворенных веществ на ионы справедливы общие законы равновесия. [8]
Как влияет диссоциация растворенного вещества на давление насыщенного пара над рязбаплеппым раствором нелетучего вещества в летучем растворителе. [9]
Растворы электролитов вследствие диссоциации растворенного вещества дают систематические отклонения, всегда показывая на опыте большее понижение темпер а-туры замерзания и большее повышение температуры кипения, чем рассчитанное по указанным формулам. [10]
 |
Принципиальная схема прямого и обратного осмоса. [11] |
Вант-Гоффа ( а-степень диссоциации растворенного вещества); R-универсальная газовая постоянная, равная 8 3143 Дж / ( моль - К); Т - абсолютная температура раствора, К; С-концентрация растворенного вещества, кг / м3; М - масса 1 моля растворенного вещества, кг. [12]
Для количественного описания процесса диссоциации растворенных веществ на ионы используют законы химического равновесия, применяемые к химическим реакциям при постоянных температуре и давлении или температуре и объеме. [13]
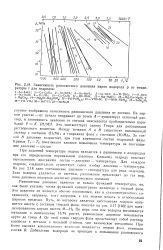 |
Зависимость равновесного давления паров водорода р от темпе. [14] |
Это соответствует закону Генри для диссоциации растворенного вещества. Между точками А а В существует насыщенный раствор с составом ( Н / М), 4 и гидридная фаза с составом ( Н / М) в. За точкой В давление возрастает, при этом изменяется состав гидридной фазы. Кривые Т, - Тз показывают влияние повышения температуры на соотношение давление - состав. [15]
Страницы: 1 2 3 4