Электролитическая диссоциация - кислота
Cтраница 2
 |
Степень электролитической диссоциации важнейших электролитов в 0 1 н. растворах.| Неорганические кислоты. [16] |
В табл. 72 - 74 приведены константы электролитической диссоциации кислот и оснований в водных растворах. Соединения расположены в алфавитном порядке. [17]
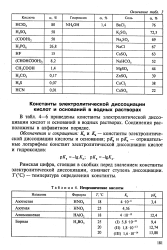 |
Неорганические кислоты. [18] |
В табл. 4 - 6 приведены константы электролитической диссоциации кислот и оснований в водных растворах. Соединения расположены в алфавитном порядке. [19]
Кислотные свойства карбоксидной группы обусловлены отщеплением протона при электролитической диссоциации кислот. [20]
Кислотные свойства карбоксильной группы обусловлены отщеплением протона при электролитической диссоциации кислот. [21]
При выборе катализатора - кислоты - нужно учитывай степень электролитической диссоциации кислоты. Это особенно важно в первой стадии конденсации для обеспечения необходимой величины рН среды при минимальном введении в смолу электролитов. При отделении смолы от водного слоя важно принимать во внимание распределение катализатора между смолой и водной частью и влияние катализатора на вторую стадию конденсации, а также при обезвоживании смолы. Безусловно необходимо учитывать значение остатков катализатора при последующей переработке смолы и влияние его на окраску смолы. [22]
Растворимость малорастворимой соли в кислоте тем больше, чем меньше константа электролитической диссоциации кислоты, анионы которой входят в состав данной соли. [23]
Растворимость малорастворимой соли в кислоте тем больше, чем меньше константа электролитической диссоциации кислоты, анионы которой входят в состав данной соли. Другими словами, чем больше растворимость данного электролита в воде и чем слабее кислота, образующая его, тем больше этот электролит растворяется в кислоте. [24]
Известно, что эти ионы образуются в водных растворах в результате электролитической диссоциации кислот и солей. [25]
Ю-4, то есть приблизительно в десять раз больше; константа электролитической диссоциации р-оксипропио-новой кислоты равна 3 X Ю-5 то есть всего в два с небольшим раза больше, чем пропионовой. Отсюда видно, что спиртовый гид-роксил, соседний с карбоксилом, оказывает наибольшее влияние. Простейшая оксикислота - гликолевая, на ней можно рассмотреть типичные для оксикислот свойства. Как кислота, она дает многочисленные ооли и разнообразные эфиры, в образовании которых принимают участие спирты, с которыми вступает в реакцию гликолевая кислота. Как спирт, гликолевая кислота дает простые и сложные эфиры. [26]
Растворимость малорастворимой соли в кислоте, тем больше, чем меньше константа электролитической диссоциации кислоты, анионы которой входят в состав данной соли. [27]
Кроме того, растворимость трудно растворимой соли тем больше, чем меньше константа электролитической диссоциации кислоты, анионы которой входят в состав данной соли. Так, в уксусной кислоте СаС О4 ( / Сшс о, 5 9 - 10 - 2) не растворяется, а карбонат кальция ( ПРСасоэ1 7 - 10 - 8; / С ] н соа 4 13 - К) -) растворяется. [28]
Употребляя при калибровке электрода буферную смесь с кислотой, константа электролитической диссоциации которой близка к константе электролитической диссоциации кислоты испытуемого раствора и рН близко к рН испытуемого раствора, можно свести ошибку опыта к очень малым величинам. [29]
Если в растворе присутствует сильная кислота или щелочь, то концентрация Н и ОН - определяется электролитической диссоциацией кислоты или щелочи. [30]
Страницы: 1 2 3 4