Электролитическая диссоциация - кислота
Cтраница 3
Следовательно, если к буферному раствору, содержащему кислоту, прибавить щелочь, то ионы водорода, образующиеся при электролитической диссоциации кислоты НАп, связываются с ионами гидроксила прибавленной щелочи, образуя слабый электролит-воду. Вместо израсходованных ионов водорода, вследствие последующей диссоциации кислоты НАп, появляются новые ионы водорода. [31]
Следовательно, если к буферному раствору, содержащему кислоту, прибавить сильную щелочь, то ионы водорода, образующиеся при электролитической диссоциации кислоты НАп, связываются с ионами гидроксила прибавленной щелочи, образуя слабый электролит-воду. Вместо израсходованных ионов водорода, вследствие последующей диссоциации кислоты НАп, появляются новые ионы водорода. В результате концентрация Н - ионов в буферном растворе изменится очень незначительно. [32]
В данном случае это различие величин коэффициента распределения связано, с одной стороны, с ассоциацией молекул уксусной кислоты в бензолен, с другой-с электролитической диссоциацией кислоты в воде. [33]
Следовательно, константа гидролиза соли сильного основания и слабой кислоты ( гидролитически основной соли) равна частному от деления ионного произведения воды на константу электролитической диссоциации кислоты. [34]
По окончании реакции равновесная система, в которой участвуют нейтральные молекулы слабой кислоты и нейтральные молекулы слабого основания, характеризуется в зависимости от величины постоянных электролитической диссоциации кислоты и основания нейтральной, кислой или щелочной средой. [35]
В данном случае это различие величин коэффициента распределения связано, с одной стороны, с ассоциацией молекул уксусной кислоты в бензоле и, с другой - с электролитической диссоциацией кислоты в воде. [36]
Уравнение ( 64) показывает, что концентрация ионов водорода в вод-ном растворе бинарных солей ( типа CH3COONH4), образованных катионами слабых оснований и анионами слабых кислот, пропорциональна произведению константы электролитической диссоциации кислоты на корень квадратный из константы гидролиза. [37]
Уравнение ( 38) показывает, что концентрация ионов водорода в водном растворе бинарных солей ( типа CH3COONH4), образованных катионами слабых оснований и анионами слабых кислот, пропорциональна произведению константы электролитической диссоциации кислоты на корень квадратный из константы гидролиза. [38]
Уравнение ( 66) показывает, что концентрация ионов водорода в водном, растворе бинарных, солей ( типа NH4C2H3O2), образованных катионами слабых оснований и анионами сильных кислот, пропорциональна произведению константы электролитической диссоциации кислоты на корень квадратный из константы гидролиза. [39]
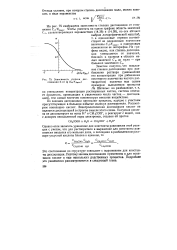 |
Зависимость степени дис социации а от lg ( С0 / / СДисс. [40] |
По законам диссоциации протекают процессы, идущие с участием присутствующих в большом избытке молекул. Электролитическая диссоциация кислот не является диссоциацией в строгом смысле этого слова. [41]
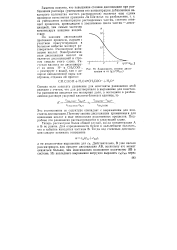 |
Зависимость степени диссоциации а от lg ( с / ЛГДис. [42] |
По законам диссоциации протекают процессы, идущие с участием присутствующих в большом избытке молекул растворителя. Электролитическая диссоциация кислот не является диссоциацией в строгом смысле этого слова. [43]
Сопоставление активной кислотности со степенью электролитической диссоциации кислот и щелочей обнаруживает непосредственную связь между ними: чем выше степень диссоциации, тем кислота ( или соответственно щелочь) химически более активна. [44]
Но если эта реакция происходит при растворении воды в серной кислоте, она должна происходить и при растворении серной кислоты в воде. Таким образом, на примере электролитической диссоциации кислот оправдывается взгляд Д. И. Менделеева на растворение, как на образование соединений между растворителем и растворяемым в нем веществом. [45]
Страницы: 1 2 3 4