Неполная диссоциация
Cтраница 2
Наряду с указанной причиной неполной диссоциации в некоторых случаях, например в случае слабых кислот и многих солей металлов, обладающих промежуточными свойствами, а также солей других металлов, электролит неполностью ионизирован. Некоторая часть этих веществ существует в виде неионизированных молекул. Прекрасным примером веществ, обладающих подобными свойствами, могут служить слабые кислоты, например уксусная. В растворе уксусной кислоты имеются неионизированные молекулы с ковалентной связью, не говоря уже о возможности образования ионных пар. С другой стороны, в случае хлористого натрия и других подобных электролитов в растворе, повидимому, нет молекул хлористого натрия с настоящей ковалентной связью, хотя и могут существовать ионные пары, в которых ионы удерживаются силами электростатического притяжения. [16]
 |
Схема образования электрического двойного слоя / /.. f на поверхности раствора вследствие различия в размерах V - / L J Ч. [17] |
Кроме того, при неполной диссоциации электролита значения х могут изменяться и в результате преимущественной ориентации недиссоциированных полярных молекул электролита одним из полюсов молекулярного диполя в сторону газовой фазы. [18]
Онзагера, указывает на неполную диссоциацию электролита. [19]
Это справедливо также в случае неполной диссоциации. [20]
Впрочем, можно допустить и неполную диссоциацию, но тогда необходимо определить тепловой эффект этой реакции при различных концентрациях и провести экстраполяцию к бесконечному разбавлению. [21]
Это может быть обусловлено либо неполной диссоциацией, либо теми допущениями, которые делаются при выводе теории Дебая - Гюккеля. [22]
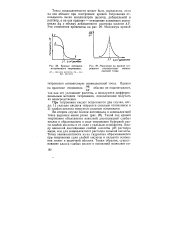 |
Кривые потенциометр ического титрования.| Максимум на кривой титрования соответствует эквивалентной точке. [23] |
Такой ход кривой титрования объясняется неполной диссоциацией слабых кислот и образованием в ходе титрования буферной смеси слабой кислоты и ее соли с сильным основанием. [24]
В реальных условиях чаще всего протекает неполная диссоциация или, соответственно, ассоциация частиц. [25]
В частности, ею объясняется также кажущаяся неполная диссоциация ионных соединений в растворе, которая проявляется в меньших величинах депрессий и осмотического давления по сравнению с ожидаемыми. [26]
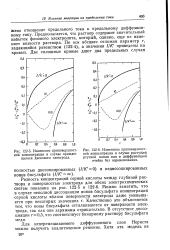 |
Изменение приповерхност - Рис, 122 - 6. Изменение приповерхностной концентрации в случае вращаю - ной концентрации в случае растущей щегося дискового электрода. ртутной капли или в диффузионной. [27] |
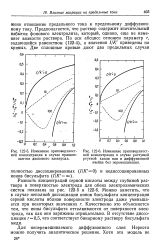
Можно заметить, что в случае неполной диссоциации ионов бисульфата концентрация серной кислоты вблизи поверхности электрода даже уменьшается при некоторых значениях г. Качественно это объясняется тем, что ионы бисульфата отталкиваются от поверхности электрода, так как они заряжены отрицательно. В отсутствие диссоциации г 0 5, что соответствует бинарному раствору бисульфата меди. [28]
Можно заметить, что в случае неполной диссоциации ионов бисульфата концентрация серной кислоты вблизи поверхности электрода даже уменьшается при некоторых значениях г. Качественно это объясняется тем, что ионы бисульфата отталкиваются от поверхности электрода, так как они заряжены отрицательно. В отсутствие диссоциации г0 5, что соответствует бинарному раствору бисульфата меди. [30]
Страницы: 1 2 3 4