Неполная диссоциация
Cтраница 3
Это отчасти может быть связано с неполной диссоциацией фторуглеродных кислот при более высоких концентрациях. [31]
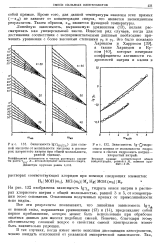 |
Зависимость lg - гидроокиси натрия от моляльности гидроокиси в смесях гидроокись натрия - хлористый натрий. [32] |
В тех случаях, когда имеет место неполная диссоциация электролитов. [33]
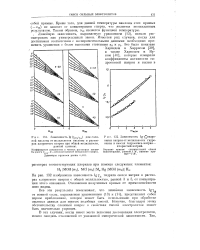 |
Зависимость lg - ( Тгидро-окиси натрия от моляльности гидроокиси в смесях гидроокись натрия - хлористый натрий. [34] |
В тех случаях, когда имеет место неполная диссоциация электролитов, можно ожидать отклонений от указанной эмпирической зависимости. [35]
 |
Зависимость эквивалентной электропроводности Я от У С для сильных ( КС1, LiCl и слабого ( СН3СООН электролитов. [36] |
Она принимает значения меньше единицы не в результате неполной диссоциации, как в случае слабых электролитов, а за счет влияния сил межионного взаимодействия. [37]
Она принимает значения меньше единицы не в результате неполной диссоциации, как в случае слабых электролитов, а за счет влияния сил межионного взаимодействия. Величина коэффициента электропроводности зависит от концентрации электролита и валентного типа. По мере разбавления эти различия исчезают. [38]
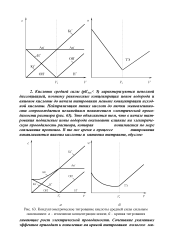 |
Кондуктометрическое титрование кислоты средней силы сильным основанием. а - изменение концентрации ионов. 6 - кривая титрования. [39] |
Кислоты средней силы ( рКдис 5) характеризуются неполной диссоциацией, поэтому равновесные концентрации ионов водорода и анионов кислоты до начала титрования меньше концентрации исходной кислоты. Это объясняется тем, что в начале титрования подвижные ионы водорода оказывают влияние на электрическую проводимость раствора, которая понижается по мере связывания протонов. [40]
Данные для НС1О4 и HNO3 были интерпретированы в предположении неполной диссоциации. [41]
Прежде всего следует отметить, что имеются данные о неполной диссоциации уранилнитрата в водном растворе. [42]
Равновесные концентрации ионов водорода и анионов кислот средней силы вследствие неполной диссоциации электролита до начала титрования меньше концентрации исходной кислоты, но все же отличаются достаточно высокими значениями и заметно влияют на электропроводность раствора. С уменьшением силы кислоты концентрации Н - и АП - - ИОНОВ все более понижаются и при значении р / Са 5 они уже практически перестают оказывать влияние на электропроводность раствора. При титровании концентрация ионов водорода нелинейно понижается, а анионов кислоты нелинейно увеличивается и в точке эквивалентности достигает максимальной величины, равной концентрации кислоты. [43]
При точных измерениях следует, однако, принимать во внимание неполную диссоциацию, причем для определения степени диссоциации, а вместе с тем и концентрации ионов металла можно пользоваться хотя бы методом электропроводности. [44]
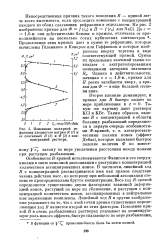 |
Изменение молярной рефракции хлористого натрия Л ( 7 и ее слагаемых П ( 2 т Ф ( 3 с концентрацией раствора. [45] |
Страницы: 1 2 3 4