Слабая диссоциация
Cтраница 2
Минимум электропроводности на изотермах электропроводности свидетельствует о слабой диссоциации антимонидов [95] при плавлении. Часть электронов закреплена в химических связях. С ростом температуры минимумы сглаживаются, происходит частичная диссоциация соединений. Это ведет к высвобождению носителей тока и должно способствовать росту проводимости. Однако повышение температуры увеличивает тепловые колебания, что ведет к понижению к, а взаимная компенсация указанных обстоятельств обусловливает весьма малый температурный коэффициент электропроводности. [16]
Так как малое значение константы электролитической диссоциации отвечает слабой диссоциации электролита, то отсюда следует вывод: равновесия в ионообменных реакциях в растворах смещаются в сторону образования наименее диссоциированных соединений. [17]
Кислоты и основания, образующиеся при гидролизе, отличаются слабой диссоциацией. [18]
При введении в глинистый раствор солей кальция коагуляция происходит вследствие слабой диссоциации ионов кальция, вытеснивших из обменного комплекса ионов натрия. [19]
Как известно, равновесие в этом случае сильно сдвинуто влево из-за слабой диссоциации воды. Другими словами, гидролиз соли, образованной сильным основанием и сильной кислотой, практически не имеет места. [20]
Движущей силой кислотно-основной - реакции [ уравнение ( 7а) ] признавалась чрезвычайно слабая диссоциация воды. [21]
Очень сильные основания характеризуются тем, что связдн-ная с ними кислота имеет чрезвычайно слабую диссоциацию. [22]
Из кислых растворов обычными смолами мышьяк ( V) практически не сорбируется ввиду слабой диссоциации мышьяковистых соединений. [23]
Так, например, оказалось, что в кристалле каменной соли при комнатных температурах имеется весьма слабая диссоциация ионов натрия, которая быстро возрастает с повышением температуры; теплота диссоциации составляет 10 000 кал / г-атом. Ионы хлора диссоциированы гораздо слабее, чем натрий при комнатной температуре; теплота их диссоциации составляет 30 000 кал. С повышением температуры диссоциация хлора растет значительно быстрее, чем натрия, и уже при 670 С хлор и натрий одинаково диссоциированы, а при более высоких температурах хлор играет преобладающую роль в электропроводности соли. [24]
Избегают использования избытка НС1 для того, чтобы ограничить образование хлорида Кроме того, вследствие слабой диссоциации HNOj образование нитрита будет происходить лишь в небольшой степени. [25]
 |
Электронная структура перекиси водорода и дисульфида водорода. [26] |
Доказательством влияния водородной связи между атомами азота и кислорода в молекуле гидроокиси аммония на ее слабую диссоциацию служит возможность получения хорошо диссоциирующей гидроокиси тетраметиламмония путем последовательного замещения водорода на метальные группы. [27]
Что же касается до слабых электролитов, то взаимодействие свободных электрических зарядов в их растворах ввиду слабой диссоциации очень незначительно, что обусловливает применимость к ним, по крайней мере приближенно, теории Арре-ниуса в ее классическом виде. [28]
Относительно быстрое изменение потенциала водородного электрода на участке аб объясняется тем, что концентрация ионов водорода, вследствие слабой диссоциации уксусной кислоты, быстро уменьшается при прибавлении небольших количеств щелочи. Замедленное же изменение потенциала на участке бв обусловливается главным образом буферным действием ( стр. Кривые титро-определяется концентрацией ионов водорода в эквивалентной точке. [29]
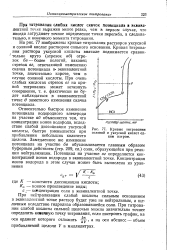 |
Кривые титрования соляной и уксусной кислот ед-натром. [30] |
Страницы: 1 2 3 4