Слабая диссоциация
Cтраница 4
Комплексы HgA2 более устойчивы, чем комплексы ZnAj, в связи с чем их диссоциация в расплаве соли не может быть изучена экстракционным методом. Имеется лишь качественное свидетельство в пользу слабой диссоциации в наиболее разбавленных хлорид-ных растворах. [46]
 |
Кривые кондуктометриче-ского титрования. [47] |
Для титрования умеренно слабой ( например, уксусной) кислоты сильной щелочью характерна восходящая кривая ( рис. I. Первоначально ионы ацетата и водорода вследствие слабой диссоциации кислоты присутствуют в равных и небольших количествах. [48]
В качестве модельного объекта исследования был выбран монокристалл широко распространенного минерала кальцита, а модельной средой служили водные растворы уксусной кислоты. Такое сочетание взаимодействующих фаз обеспечивало конгруэнтное растворение минерала и благодаря слабой диссоциации уксусной кислоты позволило эффективно регистрировать кинетику растворения карбоната кальция методом измерения электрической проводимости электролита, увеличивающейся вследствие хорошей диссоциации продукта коррозии - уксуснокислого кальция. [49]
С повышением величины рН электродный потенциал реакции ( 2) понижается, и при рН 7 5, когда потенциалы обеих реакций выравниваются, растворение железа прекращается. В концентрированных кислотах ( HN03, H2SCu и HF) он понижается из-за пассивирования металла или вследствие более слабой диссоциации кислоты. Водород, выделяющийся в процессе коррозии железа, может диффундировать в него и. [50]
С повышением величины рН электродный потенциал реакции ( 2) понижается, и при рН 7 5, когда потенциалы обеих реакций выравниваются, растворение железа прекращается. В концентрированных кислотах ( HNO3, H2SC4 и HF) он понижается из-за пассивирования металла или вследствие более слабой диссоциации кислоты. Водород, выделяющийся в процессе коррозии железа, может диффундировать в него и вызывать водородную хрупкость. [51]
Как показывают наблюдения, слабые основания ( например, водный раствор аммиака) не пригодны для регенерации сильноосновных анионитов, используемых в целях поглощения кремниевой кислоты. Плохая способность этих веществ к вытеснению из анионита ранее поглощенной кремниевой кислоты, обусловливаемая их низкими основными свойствами и слабой диссоциацией, приводит к тому, что большее количество иона НЗЮз остается в отрегенерированном материале. Ввиду этого последую-щзе фильтрование исходной воды практически не сопровождается ее обес-кремниванием, хотя в токе пропускаемой жидкости исключается возможность появления противоиона, препятствующего поглощению кремниевой кислоты. [52]
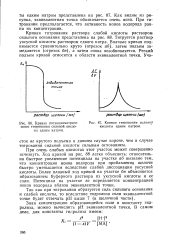 |
Кривая потенциометриче-ского титрования соляной кислоты едким натром.| Кривая титрования соляной кислоты едким натром. [53] |
При очень слабых кислотах этот участок может совершенно исчезнуть. Ход кривой на рис. 88 легко объяснить: относительно быстрое увеличение потенциала на участке аб вызвано тем, что концентрация ионов водорода при прибавлении щелочи быстро уменьшается вследствие слабой диссоциации уксусной кислоты. Более плавный ход кривой на участке бе объясняется образованием буферного раствора из уксусной кислоты и ее соли. Потенциал на участке вг определяется концентрацией ионов водорода вблизи эквивалентной точки. [54]
В очень незначительных количествах тетраборная кислота присутствует в равновесии с моноборной кислотой Н3В03 в водных растворах последней. По Тигесену ( Thygesen, 1938), в 0 6 М растворе Н3В03 молярные концентрации недиссоциированной тетраборной кислоты составляют 3 5 - 10 - 5 и иона тетрабората - 8 - 10 - 6, в то время как концентрация иона монобората вследствие чрезвычайно слабой диссоциации моноборной кислоты не превышает 4 - Ю-8. Однако с разведением равновесие быстро сдвигается в сторону иона монобората. [55]
Расчеты константы комплексообразования Кс, по Гхошу и Миттеру, могут дать правильную картину относительной прочности комплексов с различными кислотами лишь тогда, когда измерения проводят в области приблизительно полной диссоциации. В случае очень слабой диссоциации, когда справедливо уравнение (2.20), отношение КС / К будет прямо пропорционально VD при любой данной концентрации добавленной кислоты. [56]
Страницы: 1 2 3 4