Слабая диссоциация
Cтраница 3
Относительно быстрое изменение потенциала водородного электрода на участке аб объясняется тем, что концентрация ионов водорода, вследствие слабой диссоциации уксусной кислоты, быстро уменьшается при прибавлении небольших количеств щелочи. Замедленное же изменение потенциала на участке бв обусловливается главным образом буферным действием ( стр. Потенциал на участке вг определяется концентрацией ионов водорода в эквивалентной точке. [31]
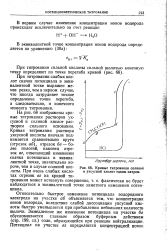 |
Кривые титрования соляной и уксусной кислот едким натром. [32] |
Относительно быстрое изменение потенциала водородного электрода на участке аб объясняется тем, что концентрация ионов водорода, вследствие слабой диссоциации уксусной кислоты быстро уменьшается при прибавлении небольших количеств щелочи. Замедленное же изменение потенциала на участке бв обусловливается главным образом буферным действием ( стр. [33]
Более того, эти произведения растворимости оказываются превышенными даже в присутствии сильных кислот, подавляющих и без того слабую диссоциацию сероводородной кислоты. Поэтому групповым реагентом 4 - й группы является сероводород в кислой среде. [34]
 |
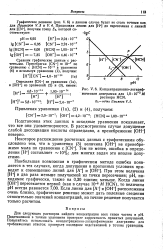
Поглощение ртути иа раствора ее сернокислой соли различными катионитими. [35] |
В опытах по поглощению ртути из раствора HgQ2 количественного извлечения Hg2 катионитом не было получено, что объясняется слабой диссоциацией хлорной ртути в растворе. [36]
Заметим, что возможности реакции кислых солей слабых кислот с металлами и окислами ограничены, с одной стороны, слабой диссоциацией ионов НСО3 - и др., а с другой - малой растворимостью их средних солей или сильным гидролизом их средних солей, что будет препятствовать протеканию реакции. [37]
Более того, эти произведения растворимости оказываются превышенными даже в при - сутствии сильных кислот, подавляющих и без того слабую диссоциацию сероводородной кислоты. Поэтому групповой реагент 4 - й группы - сероводород в кислой среде. [38]
В третью группу входят немногие отдельные галогениды ( HgCl2) CdI2, PtCl4, AuCl3 и др.), почти не подвергающиеся гидролизу вследствие своей сравнительно слабой диссоциации. [39]
В третью группу входят немногие отдельные галогеииды ( HgCb, CdI2, Р1СЦ, АиС13 и др.), почти не подвергающиеся гидролизу вследствие своей сравнительно слабой диссоциации. [40]
В третью группу входят немногие отдельные галогениды ( HgCl2, PtCl4, AuCl3, CdI2 и др.), почти не подвергающиеся гидролизу вследствие своей сравнительно слабой диссоциации. [41]
Фториды высокой степени окисления ( если только не достигается ковалентный максимум) часто гидролизуются водой, причем в данном случае важными факторами являются большая стабильность ионных окислов, а также слабая диссоциация HF в водном растворе. [42]
Величина коэффициента активности противоиона в растворе зависит от сил его взаимодействия с другими компонентами: растворителем, противоионами и, особенно, коионами. Так, из-за слабой диссоциации слабой кислоты ионы водорода сорбируются сульфокатионитом в меньшей мере, чем из этого же раствора другие противоионы. [43]
 |
Концентрационно-логарифмическая диаграмма для 1 0 10 - 3АГ. [44] |
Подстановка этих данных в исходные уравнения показывает, что все они удовлетворяются. В рассмотренном случае допущение слабой диссоциации кислоты справедливо, а пренебрежение [ ОН - ] неверно. [45]
Страницы: 1 2 3 4