Полная диссоциация
Cтраница 2
При полной диссоциации соли ВА, [ В ] [ А - ] С и [ ВОН ] можно принять равным [ НА ] в том случае, если среда раствора при гидролизе почти нейтральная. [16]
При полной диссоциации концентрации ионов - са и определяются общей концентрацией соли. Если первый раствор взять достаточно разбавленным, то fa с достаточным приближением может быть принято равным 1, и мы теперь в состоянии с помощью измерения Е для каждого значения с2 вычислить соответствующий коэфициент активности. Следует ожидать, и это отчасти подтверждается на опыте, что при умеренной концентрации коэфициенты активности одновалентных ионов будут приблизительно равны. Полное с впадение является мало вероятным, хотя бы уже по причине часто встречающегося образования комплексов. Серьезные трудности при толковании результатов измерений представляет, ввиду отсутствия надежного метода, элиминирование диффузионных потенциалов, так что дальнейшее углубление в подробности является преждевременным. [17]
Благодаря полной диссоциации сильных электролитов ионная сила их растворов быстро растет с увеличением концентрации. [18]
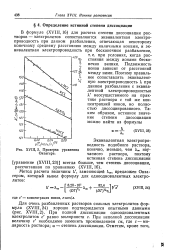 |
Проверка уравнения Онзагера. [19] |
При полной диссоциации одноодновалентных электролитов с равно молярности с. При неполной диссоциации величину с необходимо заменить произведением са, где с - мо-лярность раствора; а - степень диссоциации. [20]
Константа полной диссоциации многоосновной кислоты равна произведению ее констант диссоциации по ступеням. [21]
Константа полной диссоциации многоосновной кислоты равна произведению ее констант диссоциации по ступеням. Например, для Н3РО4 из приведенных в таблице основного текста данных получается следующее значение К. [22]
Константа полной диссоциации многоосновной кислоты равна произведению ее констант диссоциации по ступеням. [23]
При полной диссоциации ледяной уксусной кислоты ( при 0 С) в 1 л ее содержится 1 г-моль водорода. Какие ошибки ( 3) допущены в условии. [24]
 |
Изменение эквивалентной электропроводности с разбавлением раствора. [25] |
Учитывая полную диссоциацию сильных электролитов в растворах различных концентраций, на первый взгляд можно было бы ожидать, что Kv таких растворов должна быть равной АО - Этого, однако, не происходит, так как по мере увеличения концентрации ионов в растворе средние расстояния между ними уменьшаются, что приводит к усилению их взаимного притяжения. В результате перемещение каждого иона по объему раствора затрудняется и с увеличением концентрации эквивалентная электропроводность А уменьшается. [26]
Учитывая полную диссоциацию сильных электролитов в растворах любых концентраций, можно было бы ожидать, что их электропроводность ( молярная) при любых разбавлениях должна быть равна электропроводности при бесконечном разбавлении раствора. [27]
 |
Изменение эквивалент. [28] |
Учитывая полную диссоциацию сильных электролитов в растворах различных концентраций, на первый взгляд можно было бы ожидать, что А у таких растворов должна быть равной Я / о - Этого, однако, не происходит, так как по мере увеличения концентрации ионов в растворе средние расстояния между ними уменьшаются, что приводит к усилению их взаимного притяжения. В результате перемещение каждого иона по объему раствора затрудняется и с увеличением концентрации эквивалентная электропроводность Я, уменьшается. [29]
Учитывая полную диссоциацию сильных электролитов в растворах различных концентраций, на первый взгляд можно было бы ожидать, что, таких растворов должна быть равной Хг Этого, однако, не происходят, так как по мере увеличения концентрации ионов в растворе средние расстояния между ними уменьшаются, что приводит к усилению их взаимного притяжения. В результате перемещение каждого иона по объему раствора затрудняется и с увеличением концентрации эквивалентная электропроводность X уменьшается. [30]
Страницы: 1 2 3 4