Восстановление - перекись - водород
Cтраница 1
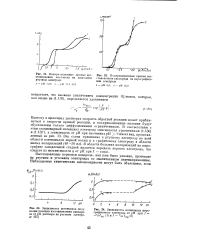
Восстановление перекиси водорода, как уже было указано, протекает на ртутном и угольном электродах со значительным перенапряжением. [2]
Альтернативно восстановление перекиси водорода может включать атаку гидроксильным водородом радикала. [3]
Катализ восстановления перекиси водорода различными донорами дает еще один пример проблемы наряду со связыванием кислорода ( разд. Кофакторами пероксидаз могут быть или флавины, или железопорфирины ( разд. Более того, можно получить полностью активные искусственные ферменты, в которых железо замещено на марганец ( разд. В противоположность этому в природе существует только один тип фермента, который предназначен специально для разложения перекиси водорода на воду и кислород. Все ферменты этого типа содержат железопротопорфи-риновый комплекс, все являются тетрамерами и характеризуются весьма близкими молекулярными весами независимо от своего происхождения ( разд. [4]
Реакция восстановления перекиси водорода может служить примером окислительно-восстановительных реакций, при которых одно вещество ( восстановитель) теряет один или несколько электронов, а другое вещество ( окислитель) принимает электроны; соответственно меняются Заряды на реагирующих частицах. [5]
Гафний катализирует восстановление перекиси водорода на ртутном капельном электроде [249], и при постоянной концентрации Н2О2 высота каталитической волны ее восстановления зависит от концентрации гафния, что можно использовать для аналитического определения гафния в растворах. В качестве фонового электролита рекомендуется серная кислота. [6]
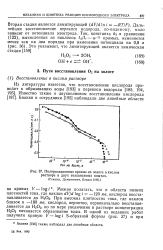 |
Поляризационные кривые на золоте в кислом растворе в двух независимых опытах. [7] |
Даль-неиш е восстановление перекиси водорода, по-видимому, мало зависит от потенциала электрода. [8]
Например, восстановление перекиси водорода иодидом катализируется соединениями шестивалентного молибдена, образующими комплексные соединения с перекисью водорода. [9]
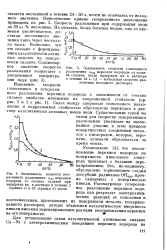
Установлено [4], что восстановление перекиси водорода на поверхности никелевого электрода протекает с большим пере - № напряжением. [11]
Следовательно, возможность окисления и восстановления перекиси водорода при срст и скорость этих процессов должны зависеть от определенной величины энергии связи радикалов с поверхностью для соблюдения неравенства фт и ф2 фст s; ф3 и ф4, когда обе реакции смогут протекать сопряженно, приводя к разложению перекиси. По данным [2], добавление меди к никелю увеличивает способность последнего к адсорбции кислорода, причем количество кислорода, обнаруживаемое на поверхности сплава после анодной поляризации, возрастает с увеличением концентрации меди. [12]
В рассматриваемом случае скорость реакции восстановления перекиси водорода ионами двухвалентного железа сравнительно невелика, поэтому для нахождения величины ее константы скорости необходимо пользоваться результатами точного решения. [13]
Проверить опытным путем, как протекает восстановление перекиси водорода солью двухвалентного железа в щелочной среде. [14]
Как показал Окамото [7], скорость восстановления перекиси водорода на поверхности нержавеющей стали AIS1 - 304 относительно мала по сравнению с другими окислителями. Этот автор объясняет различия в поведении тех или иных окислителей, предполагая их разную способность к реакции на всей поверхности и на ее активных участках. [15]
Страницы: 1 2 3 4