Восстановление - перекись - водород
Cтраница 2
Норман и Вест [125] недавно повторили исследование восстановления перекиси водорода действием оксиалкильных радикалов, применяя ЭПР-спектроскопию для наблюдения за ходом реакции. [16]
При окислительно-восстановительных реакциях с разрывом химической связи ( органические реакции, восстановление перекиси водорода и др.) возможны два пути. Первый - первичное образование относительно устойчивого ион-радикала, далее распадающегося с разрывом связи. Поскольку межатомные расстояния в ион-радикалах довольно близки к таковым в нейтральных молекулах ( и поскольку возбуждение соответствующих внутримолекулярных связей требует обычно больших квантов и потому маловероятно), постольку такой путь реакции представляется протекающим при практически неизменных внутримолекулярных координатах и аналогичен обычным окислительно-восстановительным процессам. [17]
Другой характерной особенностью ртутного и угольного электродов является значительное перенапряжение процесса восстановления перекиси водорода. [18]
Комбинированное действие окиси железа и двуокиси меди значительно более энергично при восстановлении перекиси водорода, чем действие лишь одной окиси железа; промежуточный продукт получался лишь в присутствии окиси железа. [19]
Уравнение ( 4) суммарное для двух реакций - окисления железа и восстановления перекиси водорода. Если пленка магнетита образуется по уравнениям ( 3) и ( 4), то при постоянном потенциале ( ф 0 6 в) скорость этого процесса, а следовательно, и скорость растворения железа должны зависеть от концентрации раствора. Для проверки этого предположения была измерена скорость растворения железного электрода в кислом растворе ( рН 0) с различным содержанием перекиси водорода при трех значениях фк, отвечающих различным областям потенциостатической анодной поляризационной кривой. [20]
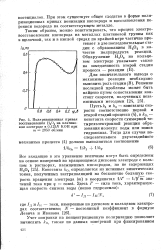 |
Поляризационная кривая восстановления Н202 на платиновом электроде в / V КОН при т 2950 об / мин. [21] |
При этом существует общее сходство в форме поляризационных кривых ионизации кислорода и восстановления перекиси водорода на соответствующем металле. [22]
Реакции восстановления гидроперекисей характеризуются цепным механизмом того же типа, что и восстановление перекиси водорода; кроме того, радикал RO - может вступать в различные реакции перегруппировки. [23]
 |
Зависимости копстапт различных путей суммарного процесса ионизации кислорода на серебряном электроде в О IN КОН отф [ 1U1 ]. [24] |
Использование дискового электрода с кольцом позволило также сделать ряд выводов относительно механизма восстановления перекиси водорода. Так, с помощью этого метода был обнаружен значительный каталитический распад перекиси водорода на платиновом, рутениевом, палладие-вом и серебряном электродах. [25]
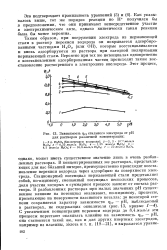 |
Зависимость фст стального электрода от рН для растворов различной концентрации. [26] |
В концентрированных же растворах, представляющих для нас больший интерес, преимущественно происходит восстановление перекиси водорода через адсорбцию на поверхности электрода. Стационарный потенциал нержавеющей стали представляет собой, по-видимому, смешанный потенциал нескольких процессов, доля участия которых в суммарном процессе зависит от состава раствора. [27]
Равновесный потенциал системы Н2О2 / Н3О при рН 0 равен 0 68 в, следовательно, восстановление перекиси водорода требует несколько более отрицательных потенциалов, чем аналогичный процесс на кислородном электроде, рассмотренный выше. [28]
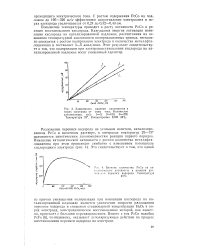 |
Зависимость падения напряжения в.| Влияние количества РсСо на каталитическую активность в реакции разложения перекиси водорода. Температуэа 25 С. [29] |
Вместе с тем РсСо подобно 1 сЬе [6], по-видимому, оказывает деполяризующее действие на процесс восстановления перекиси водорода на электроде. [30]
Страницы: 1 2 3 4