Восстановление - перекись - водород
Cтраница 3
Они установили, что такие мономеры, как акрилонитрилстирол и метилметакрилат ( если мономеры присутствуют при восстановлении перекиси водорода ионами закисного железа, меди, титана и хрома в кислом растворе), быстро полимеризуются. [31]
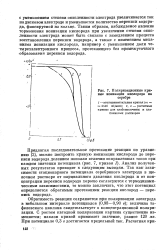 |
Поляризационные кривые ионизации кислорода на серебре. [32] |
Таким образом, наблюдаемое явление торможения ионизации кислорода при увеличении степени окисленности электрода может быть связано с замедлением процесса восстановления перекиси водорода, а также с изменением механизма ионизации кислорода, например с уменьшением доли че-тырехэлектронного процесса, протекающего без промежуточного образования перекиси водорода. [33]
В этот момент формирования пленки потенциал электрода на удаленных участках принимает значение около 0 8 - 0 9 е, при котором восстановление перекиси водорода происходит наиболее интенсивно. [34]
Точно так же реакцию ( 48) в системе вода-перекись водорода можно рассматривать как окисление воды при чтении уравнения слева направо, как восстановление перекиси водорода при чтении справа налево и как окислительный потенциал перекиси водорода при чтении справа налево с учетом действия перекиси на какой-то другой реагент. [35]
По-видимому, в этих растворах, так же как и в более разбавленных, наряду с растворением электрода за счет внешней поляризации ( анодной или катодной) происходит активное анодное растворение железного электрода, компенсируемое восстановлением перекиси водорода ( ср. Обе реакции, как известно, протекают быстро. [36]
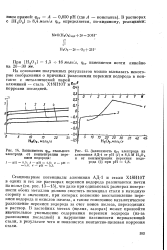 |
Зависимость фст стального [ IMAGE ] Зависимость фст электрода из. [37] |
Стационарные потенциалы алюминия АД-1 и стали Х18Н10Т в одних и тех же растворах перекиси водорода различаются почти на вольт ( см. рис. 13 - 15), что даже при одинаковых размерах поверхности обоих металлов должно сместить потенциал стали в катодную сторону к значениям, при которых возможно восстановление перекиси водорода и окислов железа, а также гомогенное каталитическое разложение перекиси водорода за счет ионов железа, переходящих в раствор. В застойных местах ( щелях, зазорах) может произойти значительное уменьшение содержания перекиси водорода ( из-за разложения последней) и нарушение пассивности нержавеющей стали, в результате чего и появляется контактно-щелевая коррозия стали. [38]
Как известно, процесс восстановления кислорода в воду протекает на ряде электродов, в том числе и на ртутном, в виде двух раздельных ступеней, которые могут быть осуществлены и изучены независимо друг от друга: первая ступень - восстановление кислорода в перекись водорода и вторая ступень - восстановление перекиси водорода в воду. Обе эти ступени мы рассмотрим в отдельности. [39]
Таким образом, представления авторов [6 - 8] о механизме активации железного электрода справедливы и для концентрированных растворов перекиси водорода. Остальная часть тока расходуется на восстановление перекиси водорода. [40]
С другой стороны, каждая молекула перекиси водорода приобретает два электрона, когда она образует две молекулы воды. Поэтому вода должна быть продуктом восстановления перекиси водорода. Перекись водорода может быть и восстанавливающим агентом, как в реакции с перманганатом калия. [41]
Наклон прямой линии, проведенной через экспериментальные точки, примерно - 600 мв. Такой высокий наклон означает, что восстановление перекиси водорода контролируется химической стадией, а не стадией с переносом заряда. [42]
В таком виде течение реакции является довольно ясным и не допускает двух толкований. Менее понятны отношения, которыми обусловливается отсутствие восстановления перекиси водорода освобождающимся водородом. По всей видимости, здесь решающим является тот факт, что перекись водорода и формальдегид, как мы установили криоскопическим методом, соединяются, образуя некоторый комплекс. В этом комплексе активный кислород защищен от воздействия освобождающегося водорода. Другими словами, скорость, с которой водородные атомы соединяются в молекулы, в данном случае больше, чем скорость, с которой может восстанавливаться комплекс формальдегида и перекиси водорода. [43]
Для определения природы гетерогенного разложения перекиси водорода на поверхности сплавов были сопоставлены значения плотности тока обмена электродных реакций i0 со скоростью саморазложения перекиси на поверхности металла в отсутствие поляризации угет. Такое определение правомерно только для электродов, на которых окисление и восстановление перекиси водорода при стационарном потенциале - единственные или преимущественные процессы. Это предполагается ( с известным приближением) для пассивирующихся сплавов исследуемой системы с содержанием не более 70 ат. Поэтому данные, приведенные ниже для сплава, содержащего 87 ат. [44]
Существенным качественным отличием процесса ионизации кислорода на достаточно активных электродах из металлов-катализаторов ( Pt, Pd, Rh, Ir, Ru, Ag) и никеля является наличие только одной площадки предельного тока диффузии на поляризационной кривой электровосста новления кислорода. Это явление, с одной стороны, обусловлено меньшим перенапряжением процесса восстановления перекиси водорода, а с другой - возможностью прямого электрохимического восстановления кислорода в воду. Последняя реакция может протекать при диссоциативной хемосорбции кислорода. В отличие от ртутного и пирографитового электродов заполнение поверхности хемосорбированным кислородом на металлах-катализаторах вблизи стационарного потенциала достигает величин, близких к монослою, а на серебряном и никелевом электродах имеет место образование фазовых окислов. Это указывает на их высокое сродство к кислороду, что обеспечивает возможность протекания диссоциативной хемосорбции со значительной скоростью. [45]
Страницы: 1 2 3 4