Восстановление - карбоксильная группа
Cтраница 3
Если карбонильная группа в альдегидах и кетонах восстанавливается довольно гладко в сравнительно мягких условиях то для восстановления карбоксильной группы требуются очень жесткие условия. Из эфиров карбоновых кислот получают соответствующие спирты в присутствии меднохромового оксидного катализатора при давлении 20 - 30 МПа и температуре 200 - 250 С. [31]
Таким образом, один гидридный эквивалент расходуется на реакцию с активным водородом и два - на восстановление карбоксильной группы. [32]
Дегидрирование соединения X может происходить в результате обычного дегидрирующего действия цинка; заслуживает внимания происходящее при этом восстановление карбоксильной группы. [33]
Таким образом, один гидридный эквивалент алюмогидрида лития расходуется на реакцию с активным водородом кислоты и два гид-ридных эквивалента на восстановление карбоксильной группы до спиртовой. [34]
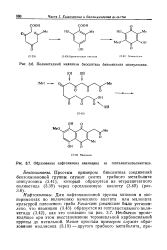 |
Поликетидиый механизм биосинтеза бензохинона спинулозина. [35] |
Для нафтохиноновой группы хинонов в экспериментах по включению меченного ацетата или малоната ультурой плесневого гриба Fusarium javanicum было установлено, что яваницин (3.43) образуется из гептаацетильного поликетида (3.42), как это показано на рис. 3.7. Необычно происходящее при этом восстановление терминальной карбоксильной группы до метильной. [36]
Отмечалось отрицательное влияние карбоксильных групп уроновых кислот на сорбируемость глюкуроноксилана целлюлозой из водных растворов [819], что объясняют повышением, благодаря этим группам степени гидратации ксилана и увеличением его растворимости, а с другой стороны - вероятным созданием пространственных затруднений для сближения молекул ксилана и целлюлозы на расстояние, достаточное для образования прочных связей. Восстановление карбоксильных групп дибораном, подавление их ионизации и сольватации добавлением к раствору соляной кислоты повышают сорбцию ксилана целлюлозой. [37]
Вторая волна восстановления аниона СН3СОО - в ацетонитриле не появляется. Восстановление карбоксильной группы возможно в очень кислых электролитах. [38]
Исходным соединением служит 5-метил - 2-аминобензойная кислота, аминогруппу которой защищают обработкой тритилхлоридом. Затем производят восстановление карбоксильной группы до спиртовой и окисление ее до альдегидной. Образовавшийся ( Р27) в реакциях конденсации самопроизвольно отщепляет защитную группу. [39]
Хотя в большинстве случаев карбоксильная группа либо остается, либо полностью удаляется, при определенных условиях могут протекать и другие превращения. Одним из наиболее неожиданных превращений является восстановление карбоксильной группы до метильной при дегидрировании селеном. Так, например, Виндаус и Тиле [299] получили 2 3-диметилнафталин из дигидропроизводного продукта присоединения малеинового ангидрида к витамину D2, а Тиле и Траутман [280] получили 2 3-диметилнафталйн из ангидрида 2 3-нафталиндикарбоновой кислоты действием селена в присутствии ге-циклогексилфенола как донора водорода. Аналогично, ангидрид 1 8-нафталиндикар-боновой кислоты был превращен в 1-метилнафталин, причем в этом случае отщепилась одна карбоксильная группа. [40]
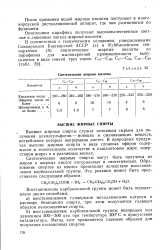 |
Синтетические жирные кислоты. [41] |
Синтетические жирные спирты могут быть получены иа жиров и жирных кислот натуральных и синтетических. Образование спиртов из кислот происходит вследствие восстановления карбоксильной группы. [42]
При температуре 220 3-фенилпропанол [91] дает циклогексил-пропанол с выходом 86 %, а 3 - ( о-оксифенил) - пропанол при 240 дает примерно равные количества циклогексильного производного и гексагидрохромана. Вторая стадия проходит не гладко, так как одновременно происходит восстановление карбоксильной группы в метильную. В качестве побочных продуктов при этих высоких температурах образуется большое количество полимеров. [43]
Как видно из табл. 2, восстановление р-циклогексаноннропиоповой кислоты возможно лишь при температуре не ниже 80 С. Однако наряду с восстановлением карбонильной группы кислоты протекает ц побочная реакция восстановления карбоксильной группы, которая становится особенно заметной при 130 - 270 С. В результате прямое восстановление э-циклогексаноппропионовой кислоты в р-циклогексшшропио-новую невозможно без предварительной защиты карбоксильной группы. [44]
Как видно из табл. 2, восстановление р-циклогекеанонпропионовой кислоты возможно лишь при температуре не ниже 80 С. Однако наряду с восстановлением карбонильной группы кислоты протекает и побочная реакция восстановления карбоксильной группы, которая становится особенно заметной при 130 - 270 С. В результате прямое восстановление р-циклогекеанонпропионовой кислоты в р-циклогексилпропио-новуга невозможно без предварительной защиты карбоксильной группы. [45]
Страницы: 1 2 3 4