Энергия - диссоциация - двухатомная молекула
Cтраница 3
В табл. 1, составленной по данным Скиннера и Смайса7 и Гей - дона18, приведены современные значения теплот образования газообразных производных бора, их средние энергии диссоциации, а также установленные спектральными методами значения энергий диссоциации двухатомных молекул ВХ. [31]
Флуоресценция также представляет большой интерес для химиков ( см. раздел I, § 9), так как позволяет проследить колебательные уровни до очень высоких значений колебательных квантовых чисел и тем самым довольно точно определять энергию диссоциации двухатомных молекул. [32]
В таблице приведены значения энергий разрыва связей, измеренные различными методами, а также вычисленные на основании принятых в данном издании значений энтальпий образования органических радикалов ( табл. 5), энтальпий образования атомов ( табл. 4), энергий диссоциации двухатомных молекул ( табл. 1) и энтальпий образования органических веществ. Значения энтальпий образования органических веществ были приняты по справочным изданиям и оригинальным работам. [33]
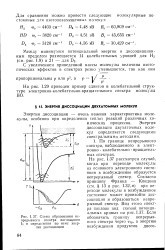 |
Схема образования не - обозначить границу непрерыв-прерывного спектра поглощения ГПРТ ТПЯ ЦРПРЧ v я чнепгию. [34] |
Энергия диссоциации двухатомных молекул определяется следующими спектральными методами. [35]
В некоторых задачах приведены величины Do - энергии ( энтальпии) диссоциации газообразных веществ на атомы или энергии атомизации кристаллических веществ при О К. Энергии диссоциации двухатомных молекул совпадают с энергиями связи и позволяют судить о прочности изучаемых молекул. Do дает возможность проверить энергию связи молекулы, вычисленную другими методами. [36]
Суть метода заключается в том, что определяются различия в электро-отрицательностях, а не их абсолютные значения, и они рассчитываются из энергий диссоциации одинарных связей или энергий связей. Энергия диссоциации двухатомной молекулы - это энергия, необходимая для того, чтобы вызвать диссоциацию молекулы на атомы в газообразном состоянии, причем и молекула и атомы находятся в основном состоянии при определенной температуре. Для двухатомных молекул, таких, как N2, в которых атомы связаны кратной связью, нельзя использовать для расчета электроотрицательности непосредственно энергию диссоциации, поскольку значение ее для кратной связи не является кратным соответствующей величине для одинарной связи между теми же атомами. Поэтому необходим косвенный метод для определения энергии простой связи между двумя атомами, которые связаны кратной связью в элементарном состоянии. Этот метод включает рассмотрение полиатомных молекул, однако в этом случае возможны следующие осложнения. Это обстоятельство важно и для теории и для практики. [37]
Суть метода заключается в том, что определяются различия в электро-отрицательностях, а не их абсолютные значения, и они рассчитываются из энергий диссоциации одинарных связей или энергий связей. Энергия диссоциации двухатомной молекулы - это энергия, необходимая для того, чтобы вызвать диссоциацию молекулы на атомы в газообразном состоянии, причем и молекула и атомы находятся в основном состоянии при определенной температуре. Для двухатомных молекул, таких, как N2) в которых атомы связаны кратной связью, нельзя использовать для расчета электроотрицательности непосредственно энергию диссоциации, поскольку значение ее для кратной связи не является кратным соответствующей величине для одинарной связи между теми же атомами. Поэтому необходим косвенный метод для определения энергии простой связи между двумя атомами, которые связаны кратной связью в элементарном состоянии. Этот метод включает рассмотрение полиатомных молекул, однако в этом случае возможны следующие осложнения. Это обстоятельство важно и для теории и для практики. [38]
В некоторых задачах приведены величины Do - энергии ( энтальпии) диссоциации газообразных веществ на атомы или энергии атомизации кристаллических веществ при О К. Энергии диссоциации двухатомных молекул совпадают с энергиями связи и позволяют судить о прочности изучаемых молекул. [39]
Имеются некоторые исключения из этого положения. Однако энергии диссоциации двухатомных молекул щелочных металлов, подобных Na2, очень низки, тогда как энергия диссоциации Н2 очень высока, и при этих условиях возможно, что среднеарифметическое уже не является хорошим приближением для рассматриваемой энергии неполярной связи. [40]
В заключение раздела остановимся еще на одной особенности энергии химической связи, а именно на энергии реорганизации, ER. Значения энергии связи и энергии диссоциации двухатомных молекул по определению совпадают. В случае многоатомных молекул эти характеристики уже различаются и подчас довольно сильно. Так, последовательный отрыв атомов водорода от СН4 требует следующих затрат энергии: Н3С - Н 435 1; Н2С - Н 457 7; НС-Н 430 1; С - Н 338 9 кДж / моль. Средняя энергия связи С - Н в метане отсюда получается равной 415 5 кДж / моль. [41]
Существует несколько методов определения энергии диссоциации двухатомных молекул. [42]
С увеличением межъядерного расстояния энергия связи в молекулах уменьшается. Примером может служить уменьшение энергии диссоциации двухатомных молекул галогенов от С12 к Вг2, 12, а также, как указывалось выше ( см. 5.2), молекул щелочных металлов. Это связано с понижением в том же направлении плотности электронного облака в молекулах, которая, естественно, должна уменьшаться с увеличением размеров атомов. [43]
Так, Гейдон [461] и Герцберг [590] предложили применять для определения энергий диссоциации двухатомных молекул спектроскопические данные. Комбинируя величины энергий диссоциации и энтальпий образования газообразных одноатомных элементов, нетрудно рассчитать энтальпии образования двухатомных молекул. [44]
Нами разработан новый метод определения энергий диссоциации X - Н связей многоатомных молекул по их инфракрасным колебательным спектрам. Подобный подход был применен еще в 30 - х - 40 - х годах 20-го века для определения энергий диссоциации двухатомных молекул. Однако до наших исследований он практически не применялся для многоатомных молекул, так как в этом случае возникает необходимость в решении колебательного уравнения Шреденгера в ангармоническом приближении. [45]
Страницы: 1 2 3 4