Энтропия - активация
Cтраница 3
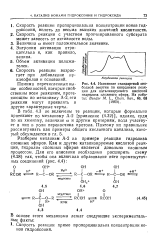 |
Изменение стандартной сво. [31] |
Энтропия активации отрицательна и, как правило, велика. [32]
Энтропия активации этой обменной реакции вдвое превышает энтропию активации любой другой реакции ( - 52 кал / ( град - моль), что указывает на образование более сложных переходных соединений. [33]
Энтропия активации не зависит от предыстории пленок. [34]
Энтропия активации, вычисленная на основании известной скорости этой реакции в нитробензоле при 60, равна - 36 1, в то время как разность энтропии образующихся и исходных веществ равна - 37 1л: а / градус. Такое совпадение означает, что активированный комплекс данной реакции по своей структуре должен быть подобен соли четырехзамещенного аммония, рассматриваемой как продукт реакции, что находится в согласии с уже сделанным предположением. [35]
Энтропии активации этих реакций близки, однако скорости их сильно различаются. Измерения показывают, что их энергии активации различны. Но отношение скорости реакции с водородом к скорости реакции с бромом ( при одинаковых температурах и концентрациях) примерно в девять раз больше, чем получится из расчета, если мы учтем разницу в энергиях активации. [36]
Энтропия активации или, иначе говоря, ориентационные требования для прямой и обратной реакций редко совпадают. Значит, в больших концентрациях накапливаются при равновесии те вещества, для взаимодействия которых необходимо выполнение особенно жестких требований ориентации. Катализатор может изменить энтропию активации, однако и в этом случае он не влияет на положение равновесия. Он влияет только на скорости. [37]
Энтропия активации близка к нулю. [38]
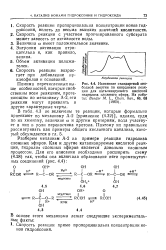 |
Изменение стандартной сво. [39] |
Энтропия активации отрицательна и, как правило, велика. [40]
 |
Энергетическая диаграмма элементарной реакции. [41] |
Энтропия активации дает некоторое представление о механизме элементарных реакций, так как она связана с изменением упорядоченности системы при образовании активированного комплекса. Для бимолекулярных реакций эта упорядоченность возрастает, а энтропия активации имеет отрицательное значение. Наоборот, для мономолекулярных реакций переходное состояние из-за удлинения рвущихся связей становится менее упорядоченным, и энтропия активации приобретает положительное значение. [42]
Энтропия активации может быть меньше нуля, если активированный комплекс имеет более упорядоченную структуру, чем исходные вещества. [43]
Энтропия активации ( отнесенная к одному пути реакции) может быть получена из экспериментального предэкспонента Ат для высоких давлений с использованием уравнения (6.7), причем вычитанием из него величины ln ( Qj 7Qi) можно при необходимости определить колебательный вклад AS в энтропию активации. Поскольку частоты колебаний молекул в общем известны, колебательная энтропия исходной молекулы SV ( A) при заданной температуре может быть рассчитана с использованием уравнений (6.9) - (6.11) для модели гармонического осциллятора. Затем следует построить модель активированного комплекса с колебательной энтропией 5j ( A) Sj ( A) ASj. На конечном этапе производится точная подгонка по одной или нескольким частотам, что делается либо вновь с помощью табл. II. [44]
Энтропия активации, в свою очередь, тесно связана со строением исходных молекул и активного комплекса. Например, разрушение сложных молекул и образование более простого по строению активного комплекса ведет к росту беспорядка в системе и сопровождается повышением энтропии. [45]
Страницы: 1 2 3 4