Выделение - палладий
Cтраница 3
Образование ацетальдегида при взаимодействии этилена с водным раствором хлорида палладия наблюдал Филлипс еще в 1894 г. Образующийся в безводной среде комплекс этилена с хлоридом палладия был описан Карашем в 1938 г. При взаимодействии палладиевого комплекса с водой происходит окисление активированного олефина с образованием ацетальдегида, выделением палладия и хлорида водорода. Шмидт в результате исследования этой реакции в 1959 г. предложил непрерывный процесс получения ацетальдегида, где восстановление металлического палладия совмещается с непрерывным его окислением кислородом воздуха. [31]
Весьма вероятно, что основной причиной торможения выделения палладия на горизонтальной ветви кривой является наличие пассивной пленки РАО; в этом случае основным процессом является реакция ионизации молекулярного кислорода. Затруднение выделения палладия на вертикальной ветви кривой, по-видимому, обусловлено возникновением на поверхности электрода пленки из труднорастворимых соединений палладия. [32]
Понижение выхода по току металла на ветви / / обусловлено совместным протеканием процесса выделения водорода. Резкое торможение скорости выделения палладия на ветви /, так же как и в других исследованных электролитах, возникает, очевидно, в результате пассивации поверхности катода в процессе электролиза. Возможно, что причиной этому является ионизация молекулярного кислорода, а также возникновение на поверхности электрода труднорастворимых соединений, образующихся вследствие изменения концентрационных соотношений в прикатодном слое. [33]
Изменение активной поверхности палладиевого катода из-за его пассивации в процессе электролиза неизбежно должно оказывать влияние на определяемые параметры кинетики катодного процесса. В этом отношении к процессу выделения палладия применимы те соображения, которые высказаны выше при рассмотрении кинетики электроосаждения металлов из цианистых растворов. [34]
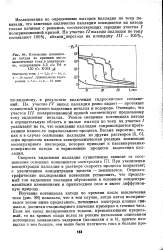 |
Изменение потенциала катрда во времени после выключения тока в электролите, содержащем 3 5 г / л Pd и 130 г / л КОН jjj. [35] |
При увеличении концентрации палладия в растворе скорость процесса возрастает; с увеличением концентрации щелочи - понижается. Осцилло-графические исследования позволили установить, что предельный ток выделения палладия обусловлен в основном концентрационными изменениями в прикатодном слое и имеет диффузионную природу. [36]
Как видно, разбавление хлоридного раствора в четыре раза заметно повышает наклон прямых, который в зоне предельного тока достигает величины, характеризующей чисто диффузионный процесс. Наряду с этим следует отметить, что величина предельного тока выделения палладия на вращающемся катоде не является прямо пропорциональной общей концентрации раствора, как это имеет место в отсутствие перемешивания электролита. Нарушение этой пропорциональности, очевидно, также связано с влиянием вращения электрода на его химическую поляризацию. [37]
 |
Кривые катодной поляризации палладия ( температура электролита 40 С.| Микроструктура палладиевого покрытия ( без подслоя серебра из амииохлорнд-иого электролита ( х450. [38] |
С увеличением концентрации КОН при постоянной концентрации палладия, значение потенциала уменьшается и понижается предельный ток выделения металла. С увеличением концентрации Pd прямо пропорционально возрастает предельное значение i K, а перенапряжение выделения палладия уменьшается. С увеличением i K от 0 07 до 0 4 А / дм2 выход палладия по току резко падает от 100 до 13 % соответственно. Микроструктура палладиевых покрытий представлена на рнс. [39]
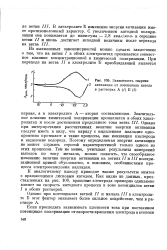 |
Зависимость энергии активации от потенциала катода в растворах А ( / Б ( 2. [40] |
Значительное влияние химической поляризации проявляется в обоих электролитах и после достижения предельного тока ветвь III. Однако при интерпретации рассчитанных величин энергии активации следует иметь в виду, что наряду с выделением палладия одновременно протекают и такие процессы, как ионизация кислорода и выделение водорода. Поэтому определяемая энергия активации не может служить строгой характеристикой только одного из этих процессов. Тем не менее, учитывая результаты измерений выходов по току металла, можно полагать, что своеобразное изменение величин энергии активации на ветвях / / и III поляризационной кривой обусловлено, в основном, особенностями процесса электроосаждения палладия. [41]
Приведенные величины эффективной энергии активации следует рассматривать как относительные, так как они характеризуют два процесса, совместно протекающие на катоде - процесс ионизации молекулярного кислорода и процесс выделения металлического палладия. Но если на ветви / удельный вес первого из этих процессов значителен, то на второй и третьей ветвях основным является процесс выделения палладия. Следовательно, увеличение доли химической поляризации на этих ветвях обусловлено процессом электроосаждения палладия. Кроме того, следует отметить, что строго вертикальное расположение ветви / / не дает возможности точно охарактеризовать на этом участке кривой зависимость скорости катодного процесса от температуры. [42]
В этом соединении палладий входит в состав комплексного катиона и вследствие этого может быть отделен при помощи катионного обмена от родия и иридия, образующих в тех же условиях аммиакаты - анионы. При добавлении к [ Pd ( NH3) 4 ] Cl2 соляной кислоты легко образуется плохо растворимый в воде транс-диамминдихлорид палладия [ Pd ( NH3) 4 ] Cl2 ( палладозамин), который может быть использован для выделения палладия из концентрированных растворов. [43]
В этом соединении палладий входит в состав комплексного катиона и вследствие этого может быть отделен при помощи катионного обмена от родия и иридия, образующих в тех же условиях аммиакаты - анионы. При добавлении к [ Pd ( NH3) 4 ] Cl2 соляной кислоты легко образуется плохо растворимый в воде гранс-диамминдихлорид палладия [ Pd ( NHs) 4 ] Cl2 ( палладозамин), который может быть использовай для выделения палладия кз концентрированных растворов. [44]
Хлористое серебро, осажденное из азотнокислых и сернокислых растворов, содержащих палладий, всегда окрашено в желтый или коричневый цвет вследствие окклюзии палладиевой соли. Для удаления примеси осадок хлорида растворяют в аммиаке и переосаждают под-хислением уксусной кислотой и добавлением нескольких капель 1 % - ного раствора хлористого аммония. Для выделения палладия фильтрат подкисляют соляной кислотой, добавляют несколько капель раствора хлорной ртути и кипятят с фосфорноватистой кислотой; промытый осадок палладия растворяют в бромсодержащей соляной кислоте ( 1: 1) и присоединяют к основному раствору платиновых металлов. [45]
Страницы: 1 2 3 4