Выделение - фермент
Cтраница 3
 |
Выход фермента и фактор очистки без стадий промывки для отношения объема образца к объему геля ( а, и при 10-кратной промывке для отношения объема элюирующсго раствора к объему геля ( б. [31] |
Более того, из рис. 3.5, а ясно, что при значительном различии между величинами / CL и KL выделение фермента происходит более легко. [32]
 |
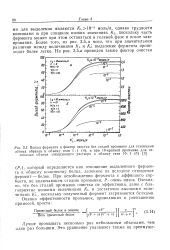
Технологическая схема выделения сухого спиртоосажденного препарата Asp. awamory. [33] |
Это выполняется чаще всего осаждением вытяжки спиртом ( этиловым, изопропиловым), но возможны, естественно, и иные способы выделения ферментов из нее, например высаливанием. При осаждении спиртом необходимо вытяжку и спирт предварительно охлаждать ( до 5 С), чтобы избегнуть инактивации ферментных белков. Кроме того, при этом способе нужно систематически регенерировать значительные количества спирта, что не представляет сложной задачи. Здесь дается технологическая схема производства сухого спиртоосажденного препарата из Asp. Производство этого препарата, равно как и других, подобных ему, состоит из двух частей: а) выращивание поверхностной культуры гриба и получение из нее диффузионной вытяжки; б) концентрирование фермента осаждением спиртом, стабилизация его ( и формирование осадка) прибавлением СаС12, высушивание, измельчение. [34]
Отсутствие специфичности к основанию, а также постоянство отношения активности фермента к фенилаланиновым производным АМФ и УМФ на всех стадиях очистки при выделении фермента [44] свидетельствуют о том, что фосфоамидаза является одним ферментом, воздействующим на различные нуклеотидоаминокислоты, а не смесью ферментов, каждый из которых гидролизует производные какого-либо определенного мононуклеотида. [35]
Если вопросы образования и применения стабилизированных ферментов вызывают устойчивый интерес ( например, в области создания терапевтических стабилизированных ферментов), то разработка путей выделения ферментов непосредственно из культуральных жидкостей представляет немалые трудности, чем, вероятно, и объясняется ограниченное число исследований в этом направлении. [36]
Сохранение активности ферментов при их электроудерживании может использоваться для локальной ферментной очистки воды в биотехнологии при иммобилизации ферментов, а также при разработке способов очистки и выделения ферментов из биологических смесей. Закрепление ферментов по типу электроудерживания имеет преимущества по сравнению с другими типами иммобилизации. Так, для его осуществления не требуется специально подготовленных коллекторов и каких-либо реактивов; источниками пригодных к закреплению ферментов могут служить как чистые кристаллические, так и технические препараты, даже бесклеточные экстракты; ферменты можно легко снять с коллектора ( для этого достаточно отключить электрическое поле и промыть систему водой), а затем использовать его для закрепления других ферментов. Существует возможность иммобилизации комплекса ферментов или смеси различных микробных культур и ферментов; электроудерживание сводит к минимуму опасность микробной порчи иммобилизованных ферментов. Существенным ограничением и недостатком злектро-иммобилизации ферментов является то, что систему нужно непрерывно держать под напряжением, а это затрудняет работу в случаях, когда субстрат или продукт реакции обладает большой подвижностью в электрическом поле, или для осуществления ферментной реакции необходима среда с высокой ионной силой. [37]
Важность пространственного удаления низкомолекулярного ингибитора от поверхности жесткой матрицы для осуществления аффинной хроматографии показана Куатреказасом и др. [5] в одной из первых работ по успешному применению этого метода при выделении ферментов. В первом случае ( рис. 5.4, а) связанный ингибитор имеет высокое сродство к а-химотрипсину и фермент можно освободить из комплекса, только если понизить рН элюирующего буфера. При использовании 0 1 М уксусной кислоты ( рН 3 0) фракция химотрипсина элюи-руется в виде острого пика и объем элюируемого химотрипсина не зависит от объема образца, нанесенного на колонку. Во втором случае ( рис. 5.4 6), ингибитор, присоединенный непосредственно к сефарозе, имеет значительно более низкое сродство к выделяемому а-химотрипсину из-за стерических препятствий, поэтому для элюирования фермента не надо заменять буферный раствор, и, как можно видеть из рисунка, фермент элюируется в значительно большем объеме сразу после неактивного материала. [38]
Выделение из исходных материалов ( ферментного сырья) необходимых ферментных белков либо в виде комплекса, либо отдельных, в той или иной степени очищенных; здесь имеется в виду в первую очередь выделение ферментов из биомассы микроорганизмов или из соответствующих культуральных жидкостей. [39]
Производство ферментных препаратов грибного или бактериального происхождения базируется на следующих основных процессах: культивировании продуцентов ферментов ( ферментации) и очистке ферментных растворов ( экстракта или куль-туральной жидкости) и их концентрировании, выделении ферментов с последующим высушиванием и стандартизации ферментного препарата. [40]
Подробное обсуждение этих реакций, а также описание очистки ферментов, участвующих в этих превращениях, приведены в обзоре Малера и в ряде оригинальных работ, где описаны химические и спектрофотометрические методы, применявшиеся при выделении ферментов и продуктов ферментативных реакций. Тем не менее относительно реакций представленных уравнениями ( 1) - ( 5), полезно сделать некоторые замечания. Будет достаточно привести описание очистки только одного из ферментов, поскольку методика является типичной, хотя она и не была одинаковой во всех случаях. [41]
Измельченные клубеньки или полученный из них сухой порошок обрабатывались в течение 20 минут фосфатным буфером рН 6 8 с добавкой аскорбиновой кислоты, центрифугировались на суперцентрифуге с охлаждением в течение 15 минут при 10000 - 12000 g, и надцентрифужная жидкость, свободная от обломков тканей и клеток, использовалась для выделения фермента. В этих условиях выпадает тонкий осадок белка ( фермент А), который отделяется от раствора центрифугированием. [42]
Определять активность протеоли-тических ферментов можно следующими способами: 1) автолизом, когда на1веску исследуемого материала заливают водой, прибавляют антисептик ( например, тимол или толуол) и под влиянием ферментов, находящихся в клетках этого же растительного материала, собственный белок расщепляется; 2) действием вытяжки фермента на препарат белка или какой-либо другой субстрат; 3) выделением ферментов из растительных тканей, очисткой этих ферментов и определением их действия на белки или препараты растительных тканей. [43]
 |
Колонка с ДЭАЭ ( диэтиламиноэтил целлюлозой для очистки аргиназы. [44] |
О ч и с т к а аргиназы методом ионообменной хроматографии на ДЭАЭ-целлюлозе. Для выделения ферментов часто используют ионообменники, приготовленные на целлюлозной основе. [45]
Страницы: 1 2 3 4