Вычисление - константа - скорость
Cтраница 2
Метод был основан на вычислении констант скоростей реакций замещения ( k) и их энергий активации ( Е), которые использовались в качестве характеристик трансвлияния внутрисферных лигандов. [16]
Иногда возникают затруднения при вычислении констант скорости реакций свободных радикалов и других промежуточных частиц, образующихся в большинстве фотохимических реакций. В обычных системах концентрация свободных радикалов очень мала ( около 10 - 10люль / д), что является следствием очень высокой реакционной способности этих частиц и относительно малых интенсивностей поглощаемого света. При обработке кинетических данных требуются специальные методы для оценки неизвестных концентраций свободных радикалов и для того, чтобы сделать возможным вычисление констант скорости и установление кинетических законов. Если фотохимическая система при данной температуре освещается светом постоянной интенсивности при условии приблизительного равенства измеряемых и локальных скоростей, разумно предположить, что очень реакционноспо-собные частицы, такие, как свободные радикалы и атомы, не являющиеся конечными продуктами, быстро достигают постоянной относительно низкой концентрации. В это время скорости реакции этих частиц равны скорости их образования. Заметим, что концентрация метильных радикалов быстро растет после начала реакции и достигает предельной величины, которая для термической реакции является наибольшей при максимальной температуре. Концентрация метильных радикалов достигает своего предельного значения за несколько секунд при 500, в то время как при 400 по истечении 60 сек она не превышает 95 % от предельного значения. Очевидно, что условие стационарности может давать разумные результаты при условии, что время образования продукта больше, чем время установления стационарного состояния. К счастью, обычно это так и бывает, хотя возможны и отклонения. [17]
Для них в химиче-ются способы вычисления констант скорости. [18]
В работе [85] приведены результаты вычисления константы скорости мономолекулярного распада в пределе высоких и низких давлений и в переходной области при одном конкретном значении температуры для каждой реакции. [19]
Как известно, вопрос о вычислении константы скорости той или иной элементарной реакции ( норного, второго пли третьего порядка) сводится к определению энергии активации и стерического фактора для этой реакции. Несмотря на то, что представление об энергии активации стало привычным в кинетике и используется уже более GO лет, тем не менее нопрос о вычислении этой величины находится в совершенно неудовлетворительном состоянии. Попытки расчета этой, величины квантово-механическими методами или какими-либо иолуэмппричоскимп методами, подменяющими в сущности реальную задачу фиктивной, оказались до сих пор несостоятельными, хотя квантовая механика качественно хорошо показала, что энергия активации является одной из форм энергии отталкивания, которая возникает при сближении частиц на критические расстояния, когда начинаются разрыв и перегруппировка атомных связей. По будущему еще предстоит решить эту задачу с, количественной стороны. Для оценки энергий активации реакций, идущих с участием радикалов, не существует даже метода подхода к решению этой задачи. [20]
При такой постановке вопроса о вычислении константы скорости мономолекулярных реакций исчезает принципиальное различие между мономолекулярными и бимолекулярными реакциями, что соответствует общей направленности классической теории мономолекулярных реакций, а с другой стороны корректирующий множитель Линдемана-Гиншельвуда не выражает еще абсолютной величины предэкспоненциального или частотного фактора и не соответствует более величине энтропийного фактора, как это принималось для адиабатических реакций. [21]
В зависимости от найденного кинетического порядка крекинга производится вычисление констант скорости крекинга. [22]
Существует несколько теоретических моделей и приближений, упрощающих вычисление константы скорости мономолекулярного распада, начиная от простейшей схемы Линдемана и приближения одинаковых гармонических осцилляторов и кончая современными вариантами теории, связанными в случае сложных молекул с трудоемкими машинными расчетами и с использованием большого числа молекулярных параметров в качестве исходных данных. Из всех таких приближений наиболее удовлетворительное описание наблюдаемых закономерностей реакции дает статистическая теория, именуемая также теорией РРКМ по имени Раиса, Рамспер-гера, Касселя и Маркуса, внесших наиболее значительный вклад в разработку основных положений теории. [23]
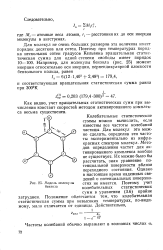 |
Модель молекулы бензола. [24] |
Как видно, учет вращательных статистических сумм при вычислении констант скоростей методом активированного комплекса весьма существенен. [25]
Эти расхождения мы объясняем тем, что обычно при вычислении констант скорости цементации упускались из вида три обстоятельства: 1) изменение величины поверхности катодных и анодных участков при цементации; 2) взаимная сопряженность катодных и анодных процессов и 3) конкурирующие катодные процессы, протекающие одновременно с процессом цементации основного металла. [26]
Развитие в последние годы методов скоростной кинетики и других непрямых методов вычисления констант скорости отдельных стадий ферментативных реакций позволяет для этих случаев провести полный расчет термодинамических параметров. [27]
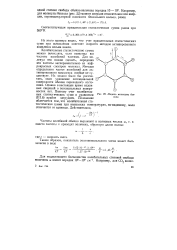 |
Модель молекулы бензола. [28] |
Из этого примера видно, что учет вращательных статистических сумм при вычислении констант скорости методом активированного комплекса весьма важен. [29]
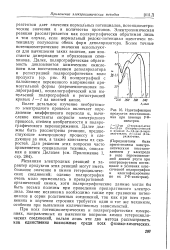 |
Идентификация продуктов восстановления при помощи УФ-спектров. [30] |
Страницы: 1 2 3 4