Диффузия - ион - железо
Cтраница 3
При испытаниях в нейтральной среде скорость коррозии низколегированных сталей в начальный период времени уменьшается во времени, однако через 80 - 100 суток она становится неизменной. III, 12 ] считают, что к этому моменту пленка достигает предельной толщины, становится пористой, и скорость диффузии ионов железа через нее поддерживается на постоянном уровне. Поскольку, по данным тех же авторов, наличие на поверхности металла окисной пленки, образовавшейся в процессе отжига при температуре 800 С, не изменило скорости коррозии железа, измеренной по количеству выделившегося водорода, очевидно, диффузия через окисную пленку не является стадией, полностью определяющей эффективность коррозионного процесса в этом случае. Скорость катодного процесса на образцах с окисной пленкой, полученной при оксидировании и образовавшейся при окислении на воздухе, и на образцах без искусственной пленки, почти что одинакова, а это также свидетельствует о том, что диффузия через окисную пленку не влияет на скорость коррозии. При температуре ниже 200 С эффективность коррозионного процесса железа определяется скоростью реакции, протекающей на поверхности раздела металл - вода. Однако, по мнению этих авторов, скорость диффузии ионов железа через окисную пленку и в этом случае оказывает некоторое ( но не определяющее) влияние на скорость коррозионного процесса. [31]
Как уже указывалось, при низкотемпературном окислении при температурах ниже 570 - 450 С на поверхности железа образуются более прочные пленки окислов, обладающие защитными свойствами. Это обусловлено тем, что на границе с железом образуется слой, состоящий из фазы Fe3O4, имеющий более высокое сопротивление диффузии ионов железа в решетку Fe304 и проникновению кислорода. [32]
С, происходит восстановление окиси железа до магнитной окиси. Там же впервые были установлены кинетические закономерности внеконтакхного восстановления окиси железа в присутствии железного порошка, найдена константа скорости реакции и показано, что лимитирующей стадией процесса является диффузия ионов железа и кислорода в твердой фазе при взаимодействии железного порошка с парами воды, содержащимися в окиси железа. [33]
Диффузия ионов железа после образования сульфидного слоя вызывает нарушение поверхностного контакта между покровом и металлом. Контакт сохраняется лишь в отдельных точках. Вследствие этого диффузия ионов железа несколько замедляется и устанавливается такая скорость ее, при которой поток атомов серы через слой сульфидов к поверхности металла может препятствовать дальнейшему нарушению контакта. [34]
По результатам исследований, выполненных в МЭИ [5.13], свободный рост кристаллов магнетита происходит в результате длительного воздействия воды высокой температуры на поверхности фер-ритной составляющей стали. При перекрытии перлитной составляющей на поверхности металла образуется сплошной слой магнетитовой пленки. Рост пленки происходит за счет диффузии ионов железа в верхние слои и ионов кислорода к основе. Окисляющее действие кислорода проявляется за счет прямого воздействия его на кристаллы пленки ( окисление магнетита до гематита) и окисления металла кислородом, проникшим между кристаллами. [35]
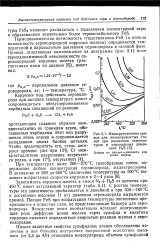 |
Изокоррозионные кривые для низкохромистых сталей при различных темпера. [36] |
С ростом температуры эта зависимость приближается к линейной и при 500 - 760 С и достаточно высоком ( 1 ат) давлении сероводорода выражается прямой. Пленки FeS при возрастании температуры постепенно превращаются в пористые слои, не представляющие барьера для сероводорода. Вследствие этого окончательно исчезает контролирующая роль диффузии ионов железа через сульфид и кинетика коррозии начинает определяться скоростью реакции железа с сероводородом. [37]
Через некоторое время активность образцов уменьшилась; уменьшение активности объясняется образованием окисной пленки. На основании описанных экспериментов авторы считают, что окисная пленка на поверхности корродирующего металла образуется за счет диффузии ионов железа через магнетит. На границе раздела окисла и воды ион железа реагирует с гидроксилионом или молекулой воды и образует гидрат закиси железа, который распадается на магнетит и воду. По данным Л. Э. Пика [111,13], в воде при температуре 300 С за счет взаимодействия с металлическим железом гидрат окиси железа переходит в магнетит. Электроны, проходящие наряду с ионами железа через окисную пленку, взаимодействуют с ионами водорода на поверхности раздела окисла и воды с выделением водорода. С течением времени толщина окисной пленки увеличивается, и диффузия ионов железа через нее затрудняется. По мнению авторов [111,12], это обстоятельство ведет к уменьшению скорости коррозии во времени. [38]
Окисная пленка на поверхности корродирующего металла образуется за счет диффузии ионов железа через магнетит. На границе раздела окисла и воды ион железа реагирует с гидроксилом или молекулой воды и образует гидрат закиси железа, в итоге образуется магнетит. В воде при температуре 300 С за счет взаимодействия с железом гидрат окиси железа также переходит в магнетит. С течением времени толщина окисной пленки увеличивается, а диффузия ионов железа через нее затрудняется. Это обстоятельство ведет к уменьшению скорости коррозии - во времени. [39]
При пониженной температуре первая стадия настолько длительна, что в опытах, средней продолжительности не удается довести процесс до второй стадии. Напротив, при высокой температуре не успевают фиксировать первый этап. Измерения параметра решетки вюстита показали, что он заметно снижается, а число вакансий увеличивается при переходе от умеренного к усиленному окислению. Другими словами, в первой стадии процесса что-то задерживает диффузию ионов железа, я они накапливаются в вюстите. [40]
Пассивирующий слой на железе хорошо проводит ток. Это видно из прямых измерений и из того, что на пассивном электроде быстро устанавливается потенциал, равный окислительно-восстановительному потенциалу раствора; кроме того, при дальнейшем повышении потенциала, с момента, когда начинается выделение кислорода ( отрезок г кривой на рис. 73), логарифм силы тока возрастает линейно с потенциалом. Поэтому нельзя объяснить быстрый перенос железа через окисныи слой омическим падением потенциала в нем, если полагать, что толщина его велика по сравнению с мономолекулярной. Экстраполяция от высоких температур показывает, что при комнатной температуре диффузия ионов железа через сплошной слой окислов толщиной в десятки ангстрем должна быть очень медленной [349], и в простом виде теория не может объяснить значительной скорости коррозии пассивного железа. По-видимому, такое применение теории Кабрера и Мотта к слою окисла микроскопической толщины законно в случаях окислов с очень малой электронной проводимостью ( например, на алюминии и тантале), а в случаях окислов со значительной металлической проводимостью оно вряд ли допустимо вообще. [41]
Так как скорость диффузии ионов железа в феррите магния несколько больше, чем в окиси магния, то при взаимодействии монокристалла окиси магния с окисью железа к границе раздела фаз MgO / MgFe2O4 ионов железа поступает больше, чем их отводится в глубь кристалла. Поэтому в локальных микрообластях поверхностного слоя MgO в какой-то момент времени концентрация железа превышает равновесную, и пересыщение снимается эпитаксиальным ростом монокристаллического слоя феррита. В зависимости от времени взаимодействия размер диффузионной зоны окиси магния увеличивается незначительно, и скорость отвода ионов железа от поверхности раздела фаз MgO / MgF2O4 меняется мало. По этой причине достижение критического пересыщения и, следовательно, скорость роста монокристаллического слоя феррита магния определяются диффузией ионов железа и магния через слой шпинели, а не их диффузией в монокристалле окиси магния. [42]
Объяснение этого факта следует искать в ориентирующем влиянии адсорбирующих слоев воды, но не субстрата, ибо пленки были очень толстыми. Однако на основании значительно большей химической активности железа по сравнению с золотом, можно предполагать, что на железе должна иметь место также и диссоциация молекул воды, что увеличивает общую адсорбцию. Чтобы представить себе причину возникновения ровной поверхности адсорбированного слоя, надо иметь в виду, что в содержащихся на поверхности металла ямках между кристаллитами молекулы воды должны удерживаться с большей легкостью, чем на выступах, что приводит к заполнению ямок в первую очередь. Наконец, если признано существование слоя воды более толстого, чем моиомолекулярный слой, то надо признавать и возможность диффузии ионов железа в водяной слой, что оказывает на него стабилизирующее действие и служит основой для дальнейшей адсорбции. [43]
На протекание этих процессов существенно влияет температура среды. При длительном воздействии воды высокой температуры на поверхности ферритной составляющей стали происходит свободный рост кристаллов магнетита правильной формы. При последующем росте они перекрывают перлитную составляющую, образуя сплошную магнетит-ную пленку. Первоначальная толщина окисной пленки - несколько атомных слоев. Образование и дальнейший рост пленки происходят за счет диффузии ионов железа в верхние слои и ионов кислорода к основе. Недостаточно высокие защитные качества самопроизвольно образующейся пленки магнетита связаны с последним процессом. [45]
Страницы: 1 2 3 4
