Активная группа - ионит
Cтраница 3
Обменная емкость по определенным активным группам всегда является шостодашой величиной, как и подлая обменная емкость нонита. Наиболее точным методом определения обменной емкости по активным группам ионита является метод по-генциометрического титрования ( определение по перегибам кривых потенциометрического титрования, стр. [31]
Этим требованиям удовлетворяют жидкие органические вещества, обладающие сравнительно большим молекулярным весом и низкими диэлектрическими проницаемо-стями. Электрод, селективный относительно данного иона, должен иметь активную группу ионита, которая обеспечивала бы требуемую селективность по отношению к интересующему иону и способна была бы к быстрому установлению ионообменного равновесия. [32]
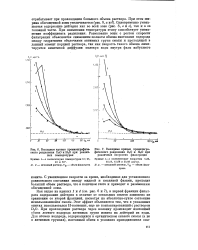 |
Выходные кривые хроматографияе-ского разделения DaO и НгО при различных температурах.| Выходные кривые хроматогра. [33] |
Как видно из кривых 1 и 4 ( см. рис. 6 и 7), в цервой фракции фильтрата содержание дейтерия в отличие от остальных опытов занижено по сравнению со второй фракцией, несмотря на абсолютно-сухое состояние использовавшейся смолы. При прохождении раствора через колонку происходит изотопный обмен легкого водорода активных групп ионита на дейтерий из воды. [34]
Степень сродства обменивающихся ионов к иониту уменьшается с увеличением радиуса гидратированных ионов и возрастает по мере увеличения валентности ионов. При этом в отдельных случаях немалую роль играет химическое сродство отдельных ионов к активным группам ионита, а также взаимодействие ионов по мере увеличения концентрации растворов. [35]
Определение равновесной обменной емко-с г и. Равновесная обменная емкость нанята, в отличие от полной обменной емкости или обменной емкости по активным группам ионита, не является постоянной. Она зависит от многих факторов ( от рН среды, концентрации растворов, свойств обменивающихся ионов и пр. [36]
Количественные характеристики электролитической регенерации смеси ионитов, а также типы используемых установок могут быть заимствованы из оригинальных работ. Отметим только, что в настоящее время экономически целесообразно проводить далеко не полную электролитическую регенерацию всех активных групп ионитов ( менее 50 %), поскольку окончательное удаление остаточных ионов сопряжено с большими затратами электроэнергии. [37]
Под селективностью понимают свойство ионита в одних и тех же условиях по-разному вступать в реакции ионного обмена с разными ионами. В соответствии с молекулярной теорией селективность ионита по отношению к ионам равных зарядов определяется степенью ассоциации активных групп ионитов с про-тивоионами. В зависимости от плотности активных групп в ионите между ними ( группами, способными к ионному обмену) возникает сила отталкивания, что является фактором, способствующим набуханию ионитов. Действию этой силы противодействует сила структурного взаимодействия. На основании изложенного можно сделать вывод, что селективность ионита возрастает с увеличением степени сшитости ионита, обменной емкости и с увеличением концентрации раствора, проходящего через ионит. Раис и Харрис [53] дали количественное описание селективности, применимое для оценки селективности ионита в неводных средах, но непригодное для ионитов с низкой степенью сшитости и с высокой набухаемостью. В ряде теорий исходят из представления о границе раздела фаз ионит - раствор как о полупроницаемой мембране. В этом случае применимо уравнение Доннана [42], и можно сделать вывод, что селективность ионита зависит от его набухания или обменного объема. При этом не учитывают межионные взаимодействия, особенно сильные в случае ионитов с высокой обменной емкостью. [38]
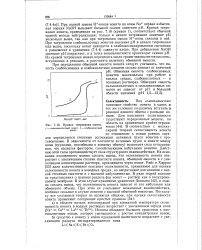 |
Кривая титрования ионита. [39] |
Под селективностью понимают свойство ионита в одних и тех же условиях по-разному вступать в. В соответствии с молекулярной теорией селективность ионита по отношению к ионам равных зарядов определяется степенью ассоциации активных групп ионитов с про-тивоионами. В зависимости от плотности активных групп в ионите между ними ( группами, способными к ионному обмену) возникает сила отталкивания, что является фактором, способствующим набуханию ионитов. Действию этой силы противодействует сила структурного взаимодействия. На основании изложенного можно сделать вывод, что селективность ионита возрастает с увеличением степени сшитости ионита, обменной емкости и с увеличением концентрации раствора, проходящего через ионит. Раис и Харрис [53] дали количественное описание селективности, применимое для оценки селективности ионита в неводных средах, но непригодное для ионитов с низкой степенью сшитости и с высокой набухаемостью. В ряде теорий исходят из представления о границе раздела фаз ионит - раствор как о полупроницаемой мембране. В этом случае применимо уравнение Доннана [42], и можно сделать вывод, что селективность ионита зависит от его набухания или обменного объема. При этом не учитывают межионные взаимодействия, особенно сильные в случае ионитов с высокой обменной емкостью. [40]
Основу синтетического ионита составляют полимерные углеводородные цепи с пространственной трехмерной структурой, которые содержат исногениые ( активные) группы. Активные группы вводятся в полимер или непосредственно при его получении, или при последующей химической обработке неполярного ( гидрофобного) полимера соединениями, содержащими будущую активную группу ионита. [41]
При смешивании в воде свежих ионитов ( катионита и анионита) они притягиваются друг к другу. Для более полного разделения ионитов перед регенерацией и последующего качественного смешивания их в рабочем фильтре необходимо нейтрализовать свободные электрические заряды противоположного знака, появляющиеся в результате электролитической диссоциации активных групп ионитов в воде. Эту операцию проводят отдельно с катионитом и анионитом перед составлением ионитной смеси. По рекомендации ВТИ катионит обрабатывают взвесью размолотого анионита в ОН-форме, а анионит - взвесью размолотого Н - катионита. [42]
Равновесие между ионитом и раствором подчиняется закону действующих масс. Повышение концентрации обменивающихся ионов в растворе способствует увеличению степени обмена. При наличии в растворе различных ионов, способных вступать в реакцию обмена, интенсивность обмена будет больше у тех ионов, которые обладают большей прочностью химической связи с активными группами ионита. Повышение относительной концентрации каких-либо из конкурирующих ионов в растворе также способствует увеличению степени их обмена. Изменяя концентрацию ионов в растворе, можно управлять процессом обмена. Так, если катионит находится в Са2 - форме, его можно перевести в Н - форму, промывая катионит в колонке раствором соляной кислоты, хотя химическая связь ионов Са2 с катионитом значительно прочней связи последнего с ионами водорода. При подаче в колонку соляной кислоты в верхней части колонки катионит в Са2 - форме придет в соприкосновение с раствором, в котором концентрация ионов Н постоянно несоизмеримо превышает концентрацию - ионов Са2, и вследствие закона действующих масс будет происходить вытеснение ионов кальция из катионита ионами водорода до полного изменения ионной формы ионита. [43]
Для проверки нашего предположения о том, что сорбированный ионитом ион устанавливает связи не только с активными, способными к обмену группами катионита, ной с группами, составляющими нерастворимый его комплекс, мы синтезировали ряд катионитов, в смоляной комплекс которых ввели вещества, способные к комплексообразованию в растворах с определенными группами ионов. Если бы при определении коэффициента избирательности этих катионитов оказалось бы, что они имеют более высокий коэффициент избирательности в отношении ионов, способных к комплексообразованию с введенными в смоляной комплекс веществами, можно было бы считать доказанным высказанное выше предположение о том, что прочность связи сорбируемых ионов с ионитом определится не только прочностью их ионных связей с активными группами ионита, но и прочностью ковалентных связей этих ионов с определенными группами нерастворимого комплекса ионита. [44]
Коэффициент распределения ионита между органической фазой и водным раствором должен быть таким, чтобы его концентрация в органической фазе значительно превышала соответствующую величину для водных растворов. Кроме того, ионит должен образовывать с определяемыми ионами более прочные комплексы, чем с любыми потенциально мешающими ионами, присутствующими в анализируемом растворе. Помимо селективности активная группа ионита должна обладать способностью вступать с определяемыми ионами в быстрое подвижное ионообменное равновесие. Как правило, эти условия выполняются, если молекулы ионита содержат длинные углеводородные цепочки с большим числом углеродных атомов. Для каждого конкретного случая практически всегда можно найти систему, удовлетворяющую данным требованиям. [45]
Страницы: 1 2 3 4