Ангулярная метильная группа
Cтраница 3
Полный синтез стероидов часто включает стадию алкилирова-ния подходящих кетонов либо с целью дальнейшего гомоаннули-рования, либо как способ введения ангулярных метильных групп. Такие реакции обычно проводятся в присутствии щелочных катализаторов и знание факторов, определяющих стереохимию образующихся продуктов, несомненно, весьма важно. [31]
Сопоставление с данными, полученными при циклизации фенантрено-вых аналогов кислоты ( 67) [202] и продуктов, не содержащих ангулярной метильной группы [195, 203], указывает, что циклизация в данном случае может протекать либо по С13 с участием двойной связи, либо по С7 с участием ароматического ядра. [32]
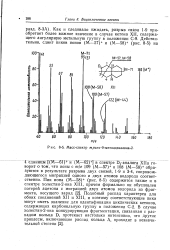 |
Масс-спектр т / анс-9 - метилдекалона-2. [33] |
Как и следовало ожидать, разрыв связи 1 - 9 приобретает более важное значение в случае кетона XII, содержащего ангулярную метильную группу в положении С-9. [34]
В данном случае ионизация тозилатной группы, по-видимому, стерически ускорена за счет ослабления компрессии между 11 ( 3-водородом и ангулярной метильной группой при образовании катионного центра при G-11 ( см. обсуждение аналогичного доведения соединения XL на стр. [35]
Присоединение метилвинилкетона к 2-метилциклогексанону - 1 с последующей циклизацией путем кротоновой конденсации приводит к окталону ( 461, /) с ангулярной метильной группой. Поскольку присоединение по Михаэлю протекает с большой стереоспецифичностью, оно имеет большое значение для синтезов стероидных соединений. Все известные до сих пор синтезы веществ этого класса проходят через стадию присоединения по Михаэлю. [36]
Гидроксил холестерина np: i С-3 имеет ( 3-ориентацию; ту же ориентацию имеет и боковая цепь, связанная с С-17, а также обе ангулярные метильные группы. Эти заместители обладают такой же ориентацией в холестаноле - предельном соединении, полученном каталитическим гидрированием холестерина. [37]
Однако в Л-4 р-изомере 160 при ориентировании кислорода, необходимом для осуществления переноса З - атома водорода, фенильное кольцо подвергается сильным 1 3-диаксиальным воздействиям как со стороны ангулярной метильной группы, так и со стороны 2 3-атома водорода. Этот изомер не изменяется при кипячении в бензоле, что подтверждает изложенный выше конфор-мационный анализ. [38]
Селективное восстановление аддукта ( 235) привело к трикетону ( 236), Переход от последнего к природным стероидам требует эпимеризации по С14, удаления 15-кетогруппы и Л9 ( 11-связи, введения ангулярной метильной группы и превращения шестичленного кольца D в нятичленное. [39]
Эта реакция имеет большое значение, так как аддукт Михаэля в дальнейшем за счет альдольного присоединения пли альдолыюй конденсации в присутствии щелочи превращается в циклический альдоль VI1) или а, р-ненасыщенный кетон VII, которые содержат ангулярную метильную группу. В соединении VII легко обнаружить часть скелета стероидов ( кольца А и В), поэтому присоединение по Михаэлю эффективно используется для синтеза стероидов. [40]
При нагревании с раствором НС1 в уксусной кислоте дикетоны ( VI) и ( VII) изомеризуются с перемещением двойной связи в различные дикетоны, а это показывает, что эти аддукты являются изомерами по расположению кольца D относительно ангулярной метильной группы и кольца С. [41]
В 9р - метил-тра с-декалине метильная группа расположена аксиально по отношению к обоим кольцам, вледствие чего ее Н - атомы отталкиваются аксиальными водородами каждого кольца. В с-изомере ангулярная метильная группа является аксиальной по отношению к одному кольцу, но экваториальной к другому, и, следовательно, увеличение энергии напряжения составляет только половину от предыдущего. Поэтому разница в энергии меньше, чем у незамещенных декалинов. [42]
У животных при превращении андрогенов в эстрогены ( см. разд. V) происходит окислительное отщепление ангулярной метильной группы при С-10, предшествующее ароматизации кольца А. Структура геллебригенина и других 19-окислен-ных растительных стероидов указывает на то, что аналогичные превращения могут происходить также у растений. [43]
В основе структуры лежит ядро гонана ( стерана), сочлененное по положениям 16 и 17 с гетероциклами. В положениях 10 и 13 имеются две ангулярные метильные группы, а в положении 3 - гидрокси-группа, по которой обычно происходит гликозидирование. Для некоторых типов стероидных А. [44]
Селинен, который также содержит метальную группу при четвертичном атоме углерода, превращается в эйдалин и тетра-гидроселинен при температуре 205, правда, с относительно малой скоростью. Это, вероятно, первый описанный случай отщепления ангулярной метильной группы в условиях каталитической дегидрогенизации при столь низкой температуре. [45]
Страницы: 1 2 3 4