Двуокись - рений
Cтраница 1
Двуокись рения образуется также при упаривании рениевой кислоты с гидразином. Она получается и в результате гидролиза хлороренатов ( см. стр. Электролитическое восстановление рениевой кислоты и ее солей представляет собой еще один метод получения гидратиро-ванной двуекиси рения. [1]
Двуокись рения легко окисляется и поэтому при осаждении и промывании ее возможны значительные потери рения. Кроме того, осадок двуокиси рения легко адсорбирует находящиеся в растворе ионы щелочных и других металлов. Вследствие этого определение рения в виде двуокиси недостаточно надежно и мало используется в лабораторной практике. [2]
Двуокись рения ReO2 - черные гексагональные кристаллы, плотн. При сплавлении с щелочами на воздухе образуется перренат, а в вакууме - ренаты и рениты. Получают ReO2 восстановлением высших окислов водородом или длительным нагреванием рения с Re207 при 600 - 650, а также прокаливанием перрената аммония при 400 в инертной атмосфере. [3]
Двуокись рения Re02, полученная сухим путем или дегидратацией Re02 - 2H20 в вакууме при 650, представляет собой слабо парамагнитный нелетучий коричнево-черный кристаллический порошок с плотностью 11 4 г / см3; она устойчива в отсутствие кислорода и диспропорционирует на Re207 и металлический рений при нагревании без доступа воздуха или в вакууме. В присутствии кислорода воздуха нагревание Re02 ведет к превращению в Re207 - соединение желтого цвета. [4]
Гидрйтированная двуокись рения может быть приготовлена при действии на растворы перренатов различных восстановителей или электрохимическим восстановлением в пекомплексообразующих средах. [5]
У двуокиси рения кислотные свойства преобладают над основными. [6]
Осадок двуокиси рения восстанавливают водородом. Метод дает хорошие результаты по очистке от примесей щелочных и щелочноземельных металлов. [7]
При сплавлении двуокиси рения с едким натром и едким баритом при 500 в атмосфере азота получается ренат бария. Ренат бария BaRe04 представляет собой зеленое, цвета травы, твердое вещество, в то время как перренат бесцветен, а манганат бария синевато-зеленый. [8]
Установлено, что двуокись рения реагирует с сернистым газом, но никакого определенного соединения изолировано не было. При обработке такими окислителями, как азотная кислота, перекись водорода, хлорная или бромная вода, двуокись рения легко окисляется до рение-вой кислоты. [9]
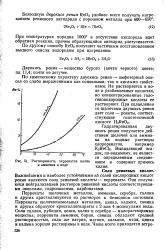 |
Растворимость перренатов калия и аммония в воде. [10] |
По химическому характеру двуокись рения - амфотерный окисел со слабо выраженными как основными, так и кислыми свойствами. Не растворяется в воде и разбавленных кислотах, но концентрированные гало-геноводородные кислоты ее растворяют. [11]
При действии газообразного хлористого водорода двуокись рения образует оксихлорид. Утверждалось также, что при этом образуется и четыреххлористый рений, но хлор при этой реакции не выделяется, так как двуокись рения не является окислителем. Напротив, она обладает восстановительными свойствами, так как соединения четырехвалентного рения имеют склонность окисляться; при этом элемент переходит в семивалентное состояние. [12]
Высшие окислы рения кислотные, двуокись рения амфотерное соединение, a ReO и Re2Os - основные окислы. [13]
Оба вещества приготовлены действием фтора на двуокись рения или перренат калия при 100 С и оба при гидролизе давали только надрениевую и фтористоводородную кислоты Позднее действием жидкого фтористого водорода на соответствующий оксихлорид. [14]
При сильном нагревании в токе водорода двуокись рения восстанавливается до элемента, который может остаться в пирофорном виде и воспламениться, если его еще в теплом состоянии привести в соприкосновение с воздухом. [15]
Страницы: 1 2 3 4