А-спираль
Cтраница 1
Однородная а-спираль устойчива: включение в нее остатков с противоположной конфигурацией снижает ее стабильность, поэтому рацемическая смесь полимеризуется намного медленнее, чем оптический изомер. Однако скорость полимеризации последнего, если к нему добавить антипод, снижается больше, чем в том случае, когда каждый изомер полимеризуется отдельно. Это объясняется тем, что полимеризация, например, d - изомера, инициируемая а-пептидами, полученными из 1-изомера, протекает сначала медленно, и быстрая полимеризация начинается только тогда, когда к инициатору присоединится достаточно d - звеньев, чтобы образовать из них спираль. [1]
Ненарушенная а-спираль является формально иррациональной спиралью. В каждом ее витке содержится приблизительно 3 6 аминокислотных остатка. Две пептидные группы, разделенные в цепи еще двумя такими группами, связаны между собой водородной связью. [2]
Менее жесткая сжатая А-спираль скручивается, вероятно, в более компактное третичное образование, чем растянутая В-спираль. [3]
Позднее а-спирали были обнаружены во многих волокнах [184], в частности в а-кера-тине и парамиозине и почти во всех глобулярных белках. В самом деле, обозначения а и р для а-спирали и р-структуры появились в связи с тем, что все рентгенограммы волокон подразделяли на а - и р-рентгено-граммы, которые получали в основном от образцов а-керати-на и р-фиброина шелка. [4]
 |
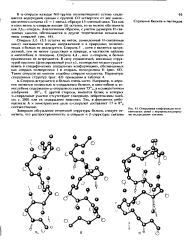
Спираль с тремя остатками на виток ( по Хагеймайеру. [5] |
Принципиально а-спираль может быть образована как L -, так и D-аминокислотнымн остатками. Склонность полипептидной цепи к образованию спиральной структуры в значительной степени зависит от природы боковых цепей аминокислот. В случае кислых и основных аминокислот дестабилизирующее действие определяется наличием зарядов на боковых группах. [6]
Позднее а-спирали были обнаружены во многих волокнах [184], в частности в а-кера-тине и парамиозине и почти во всех глобулярных белках. В самом деле, обозначения а и р для а-спирали и р-структуры появились в связи с тем, что все рентгенограммы волокон подразделяли на а - и р-рентгено-граммы, которые получали в основном от образцов а-керати-на и р-фиброина шелка. [7]
 |
Спиральные конфирмации поли пептидных цепей с внутримолекулярными водородными связями. [8] |
В а-спирали каждая NH-группа полипептидного остова соединяется водородной связью с группой СО четвертого от иее аминокислотного остатка ( 5 - - 1 связь) образуя 13-членный цикл. Так как в один виток а-спирали входит 3 6 остатка, то ее можно обозначить как 3 6i t - спираль. [9]
В а-спирали последовательно расположенные аминокислотные. [10]
В а-спирали, где имеются межмолекулярные водородные связи, в группах / N - Н О - С. [11]
 |
Топология 0-форм в белках. [12] |
Оси а-спиралей не обязательно параллельны друг другу. Ричардсон показала, что соответствующие геометрические мотивы подобны орнаментам на античных вазах. [13]
Суперспирализация а-спирали энергетически выгодна, поскольку упаковка боковых цепей способствует образованию дополнительных благоприятных вандерваальсовых контактов между а-спиралями. Если взаимодействующие боковые цепи гидрофобии, то уменьшение свободной энергии такой структуры будет особенно эффективным, поскольку, располагаясь вдоль оси суперспирали, в этом случае боковые цепи экранированы от контактов с молекулами растворителя. В тропомиозине положения е и g часто заняты заряженными остатками, которые образуют солевые мостики с находящимися напротив остатками g и е соответственно. [14]
 |
Параллельная р-структура флаводоксина ( по В. М. Степанову. пунктиром показаны водородные связи. [15] |
Страницы: 1 2 3 4 5