А-спираль
Cтраница 2
Содержание а-спиралей в белках неодинаково и является индивидуальной особенностью каждой белковой макромолекулы. Для некоторых белков, например для миоглобина, а-спираль лежит в основе структуры, другие, например химотрипсин, не имеют а-спирализованных участков. Спирализованные участки чередуются с хаотическими клубками, причем в результате денатурации переходы спираль-клубок увеличиваются. Спирализация полипептидной цепи зависит от аминокислотных остатков, ее образующих. Так, отрицательно заряженные группы глутаминовой кислоты, расположенные в непосредственной близости друг от друга, испытывают сильное взаимное отталкивание, что препятствует образованию соответствующих водородных связей в а-спирали. По той же причине спирализация цепи затруднена в результате отталкивания близко расположенных положительно заряженных химических группировок лизина или аргинина. Наиболее часто интерферирующим фактором при образовании а-спирали является аминокислота пролин. Как известно, в пролине атом азота входит в состав жесткого кольца, что препятствует вращению вокруг связи N-Са. Кроме того, пролин не образует внутрицепочечную водородную связь из-за отсутствия при атоме азота водородного атома. Таким образом, во всех случаях, когда в полипептидной цепи встречается пролин, а-спиральная структура нарушается и образуется клубок или р-изгиб. [16]
Размеры а-спирали [100] даны в подписи к рис. 45, на котором приведена аксиальная проекция четырех остатков правой спирали. [17]
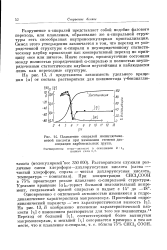 |
Плавление спиралей полиглютами-новой кислоты при изменении степени диссоциации карбоксильных групп. [18] |
Разрушение а-спиралей представляет собой подобие фазового перехода, или плавления, образование же а-спиральной структуры есть своеобразная внутримолекулярная кристаллизация. Смысл этого утверждения заключается в том, что переход от упорядоченной структуры а-спирали к неупорядоченному статистическому клубку происходит как кооперативный переход по принципу все или ничего. Иначе говоря, промежуточные состояния между полностью упорядоченной а-спиралью и полностью неупорядоченным статистическим клубком неустойчивы и наблюдаются лишь как переходные структуры. [19]
Сколько а-спиралей скручено друг с другом, пока еще не удалось точно установить. Исследование, проведенное в работе [82], дает основание считать, что миозин, а-кератин и тропомио-зин в сухом состоянии, так же как и парамиозин, с наибольшей вероятностью имеют двойную сверхспираль. [20]
Виток а-спирали ( 3 6 остатка) измерен параллельно ее оси, его длина равна 5 41 А. [21]
 |
Участок антипараллельной Р - конформации ( остатков /. - аминокислот. [22] |
В правой а-спирали ( рис. 23.7.3) водородная связь возникает между протоном амидной группировки N - Н i -остатка и карбонильной группой ( t - 4) - остатка. В более общем случае, когда полипептид построен путем ступенчатого наращивания различных остатков аминокислот, влияние различия структуры боковых радикалов обычно сильнее, чем тенденция к принятию упорядоченной конформации, возникающей из-за структурной регулярности скелета молекулы. В общем случае молекула принимает случайную или неупорядоченную конформацию. Это справедливо и для глобулярных белков, включая ферменты, где молекула в целом не принимает упорядоченной конформации, но тем не менее отдельные участки полипептидной цепи имеют упорядоченную конформацию там, где комплементарные боковые радикалы группируются друг с другом. [23]
Виток а-спирали фибриллярного белка ( 3.6 аминокислотных остатков) измерен параллельно ее оси. Его длина равна 0 5 нм. [24]
Из а-спиралей молекул актина образуется ( по типу конец к концу) две скрученных цепи, причем в спиральном желобке между ними располагается другой белок, тропомиозин. Тропомиозин, как полагают, представляет собой агрегат нескольких полипептидных цепей, образующих скрученные витки. Каждая молекула взаимодействует с семью молекулами актина. Молекула тропомиозина связывается также с молекулой тропонина, состоящего из трех субъединиц. Субъединица Т связывается с тропомиозином, субъединица I - с актинтропомиозиновым комплексом, а субъединица С-с субъединицами Т и I. В отсутствие ионов Са2 субъединицы Т и I предотвращают сокращение, ингибируя взаимодействие между актином и миозином. При низких концентрациях иона Са2 субъединица С лишь слабо связана с субъединицей I. При более высоких концентрациях Са2 последний связывается субъединицей С, которая затем прочно связывается с субъединицей I, удаляя последнюю из актин-тропомиозинового комплекса. Ион Са2, таким образом, действует в качестве депрессора релаксации. [25]
Укладка а-спиралей вокруг квазишарового ядра ( то есть таким образом, что длина, ширина и толщина глобулы примерно равны) является наиболее типичной для - спиральных глобулярных белков. [26]
Поскольку в а-спирали на один виток приходится примерно четыре аминокислоты, то в случае, когда каждая пятая аминокислота в полимерной белковой цепи является гидрофрбной ( а остальные - гидрофильные), при образовании а-спирали на ее внешней поверхности образуется полоска из гидрофобных аминокислот, приблизительно параллельная оси а-спирали. В этом случае контакт а-спирали с гидрофобной поверхностью / 3-листа Или соответствующей гидрофобной полоской другой а-спирали ( при образовании домена из а-спиралей и 0-листов) приведет к наибольшему выигрышу энергии. [27]
Что касается а-спирали, то очевидно, что ее гибкость ( без разрыва водородных связей) может иметь только персистентный характер; соответствующая длина куновского сегмента - 200 нм. Различие куновских сегментов столь велико, что в определенном диапазоне молекулярных масс получается так: в исходном состоянии цепочка представляет собой полноценный клубок ( гауссов или набухший), так как контурная длина намного больше персистентной; та же цепь после спирализации выглядит как почти абсолютно жесткий стержень, так как длина спирали меньше ее персистентной длины. Конечно, цепь большей длины и в спиральном состоянии оказывается как целое клубком. [28]
 |
Изменение оптической активности при переходе спираль - клубок. [29] |
Следователыно, а-спираль должна обладать оптической активностью независимо от оптической активности звеньев. Угол поворота плоскости поляризации света белком слагается из угла поворота, определяемого асимметрией звеньев, и из угла, определяемого винтовым строением а-спирали. [30]
Страницы: 1 2 3 4 5