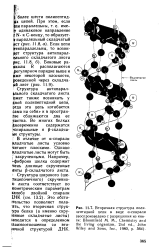
А-спираль
Cтраница 4
Что представляет собой а-спираль. [46]
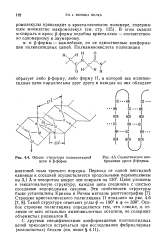 |
Общая структура полипептидной цепи в ( 5-форме.| Схематическое изображение кросс ( 5-формы. [47] |
В этом смысле а-спираль и кросс р-форма подобны кристаллам - соответственно одномерному и двумерному. [48]
Вторичные структуры - а-спирали и р-формы реализуются в чистом виде у полиаминокислот, не являющихся информационными макромолекулами. Соответственно эти структуры имеют монотонное периодическое строение. [49]
В отличие от а-спирали кладчатые листы условно Читают плоскими. Однако Кладчатые листы могут быть закрученными. Например, фиброин шелка содержит ( чень длинные скрученные жнты р-складчатого листа. Это обсто-гтельство позволяет пола - ать, что вторичная струк-ура белка ( а именно скру - 1енные складчатые листы) 1аходится в определенном ( Заимоотношении со вторичной структурой ДНК. [51]
В отличие от а-спирали р-структура образована за счет межцепочечных водородных связей между соседними участками полипептидной цепи, так как внутрицепочечные контакты отсутствуют. [52]
Речь идет об а-спирали. [53]
В отличие от а-спирали в коллагеновой цепи отсутствуют водородные связи. Вместо них стабилизацию спирали обеспечивают силы стерического отталкивания пирролидиновых колец в радикалах пролина. В коллагене содержатся углеводные единицы, связанные с остатками гидроксилизина, чаще - это дисахарид из глюкозы и галактозы. Вторичная структура - понятие условное, это особый колла-геновый тип: гибрид между а-спиралью и р-структурой, представляющий собой линейную правую суперспираль из трех полипептидных цепей. Такая молекула называется тропоколлагеном. Три цепи связаны между собой водородными связями между NH-группами глицина и СО-группами аминокислотных остатков других цепей. Кроме того, в образовании водородных связей участвуют гидроксильные группы остатков гидроксипролина и молекулы воды. Водородные связи направлены поперечно к длинной оси тропоколлагена. [54]
Могут ли образовываться левовинтовые а-спирали. [55]
В стабильных белках соседние а-спирали ориентированы так, что выпуклости одной совпадают с впадинами другой и наоборот, в результате чего получается своеобразная шарнирная система, сочетающая устойчивость структуры с подвижностью и допускающая более компактную упаковку полипептидных цепей в белковой молекуле. [56]
Могут ли образовываться левовинтавые а-спирали. [57]
Таким образом возникает а-спираль Полинга - Кори [38] ( рис. 1.20), на каждый ее виток приходится 3 6 мономерного звена ( класс симметрии 3 6) и з среднем три водородные связи, стабилизирующие виток. Ограничение подвижности каждого звена и каждого витка придают при этом макромолекуле вытянутую конфигурацию, устойчивость которой может быть рассчитана. [58]
Аминокислоты могут образовывать только правые а-спирали, причем боковые радикалы расположены по обе стороны оси и обращены наружу. В а-спирали полностью использована возможность образования водородных связей, поэтому она не способна в отличие от р-структуры образовывать водородные связи с другими элементами вторичной структуры. При образовании а-спирали боковые цепи аминокислот могут сближаться, образуя гидрофобные или гидрофильные компактные сайты. Эти сайты играют существенную роль при образовании трехмерной конформации белковой макромолекулы, так как используются для упаковки а-спиралей в пространственной структуре белка. [59]
Полагают, что а-спирали вторичных структур белка соединяются бок о бок, одна рядом с другой - субъединица белка здесь представляет собой пласт полипептидных спиралей, а не кабель или пучок. [60]
Страницы: 1 2 3 4 5