А-спираль
Cтраница 3
 |
Изменение оптической активности при переходе спираль - клубок. [31] |
Следовательно, а-спираль должна обладать оптической активностью независимо от оптической активности звеньев. Угол поворота плоскости поляризации света белком слагается из угла поворота, определяемого асимметрией звеньев, и из угла, определяемого винтовым строением а-спирали. [32]
Белки, а-спираль - пространственное расположение последовательности аминокислот ( один из вариантов вторичной структуры белка), при котором полипептид образует регулярную спираль о шагом 5 44 А и диаметром 10 5 А. На каждый виток о-спирали приходится по 3 7 аминокислотного остатка, а на один аминокислотный остаток - 1 5 А длины спирали. Между атомом водорода в каждой пептидной группировке и карбонильным атомом кислорода третьей по счету от нее аминокислоты возникают внутрицепочечные водородные связи, направленные вдоль оси спирали. Водородные связи появляются после образования спиральной структуры, закрепляют ее и стабилизируют. [33]
Представление о а-спирали и структурах типа складчатого слоя возникло не как вывод из прямых экспериментальных данных, полученных на белках, а скорее как теоретическое обобщение, основанное на изучении молекул более простых веществ. В аминокислотах один из атомов углерода, называемый а-атомом углерода ( Са), расположен между амино - и карбокси-группами. [35]
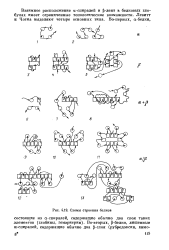 |
Схемы строения белков. [36] |
Взаимное расположение а-спиралей и - лент в белковых глобулах имеет ограниченные топологические возможности. Левитт и Чотиа выделяют четыре основных типа. [37]
Один виток а-спирали образуют 3 6 аминокислотных остатка. Как и любая другая спираль, а-спираль может быть правой или левой. В белках встречаются только правые а-спирали. [38]
Вторичную структуру а-спирали имеют, например, миозин и а-кератин. [39]
Вторая особенность а-спирали связана с образованием максимально возможного числа водородных связей - по две на каждую пептидную группу. Водородные связи приблизительно параллельны оси спирали, причем каждый пептидный азот связан водородом с карбонильным кислородом третьего ближайшего остатка. Следовательно, каждая водородная связь перекрывает три аминокислотных остатка и удерживает их в упорядоченной конфигурации независимо от двух других Н - связей. Для того, чтобы могло осуществиться нарушение жесткой структуры ос-спирали на каком-то ограниченном участке, должны быть разорваны по меньшей мере три последовательные водородные связи. Это обстоятельство имеет решающее значение в придании а-спирали большой стабильности, равно как и резкости перехода спираль - - клубок. [40]
Показаны размеры отдельных а-спиралей. [41]
 |
Сверхвторичная рарар-структу-ра ( греческий орнамент. [42] |
Короткие участки суперспирализованных антипараллельных а-спиралей присутствуют и в некоторых глобулярных белках. Весьма компактную левую тройную спираль образуют параллельные спирали типа полипролина в коллагене ( см. с. Другая распространенная группа супервторичных структур - различные варианты так называемой рсф-структуры, в которой ct - епираль взаимодействует с р-складчатым листом. [43]
Каждые три правовращающих а-спирали навиты одна на другую в стержнеобразную структуру, получившую название протофибрилла и имеющую диаметр 2 нм. Из-за скручивания период идентичности сокращается от 0 54 нм для нормальной а-спирали до 0 51 нм. С помощью электронной микроскопии удалось показать, что каждые 9 протофибрилл накладываются кольцевыми витками на 2 других, образуя при этом структуру, похожую на кабель, называемую микрофибриллой и имеющую диаметр 8 нм. Многие сотни микрофибрилл, уложенных для увеличения механической прочности в богатую цистеином белковую матрицу, снова образуют так называемые макрофибриллы с диаметром 200 нм. Макрофибриллы лежат параллельно оси волокна в отмерших клетках шерсти. Конечный диаметр всей структуры достигает 20 000 нм. [44]
Форма представляет искаженную а-спираль, упакованную в тетрагональную структуру, в которой все спирали имеют винтовую ось четвертого порядка. По-видимому, это искажение вызывают взаимодействия между бензильными группами. Форму можно получить при нагревании приблизительно до 160 С полипептида в форме а-спирали и последующем охлаждений, очевидно, без потери ориентации. В работе использована модель, в которой доля / полимера обладает совершенной ориентацией, а для ( 1 - /) полностью дезориентирована. Предполагалось, что направление момента перехода валентного колебания NH-связи известно. [45]
Страницы: 1 2 3 4 5
