А-химотрипсин
Cтраница 1
Кристаллический а-химотрипсин образует два типа контактов А и В с осями симметрии 2-го порядка. [1]
Свойства а-химотрипсина могут быть охарактерированы на основании рассмотрения структур XIII и XIV, в которых центральные углеродные атомы имеют L-конфигурацию. Пунктирные линии изображают разрывающиеся связи. [2]
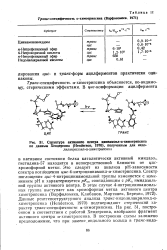 |
Гракс-спецнфичность а-химотрипсина ( Варфоломеев, 1971.| Структура активного центра циннамоил-а-химотрипсина по данным Хендерсона ( Henderson, 1970, полученным для индо. [3] |
Грамс-специфичность а-химотрипсина объясняется, по-видимому, стерическими эффектами. [4]
В катализе а-химотрипсина при комплексообразовании субстратов с активным центром фермента наблюдаются заметные спектральные изменения на длинах волн поглощения белка. [5]
В присутствии а-химотрипсина в спектре ЯМР 19F наблюдается смещение сигналов обоих энантиомеров в сторону слабого поля. [6]
Механизм действия а-химотрипсина в настоящее время изучен, вероятно, более подробно, чем любого другого фермента. Физио-роль этого фермента сводится к катализу связей пищевого белка в кишечнике Он выделяется поджелудочной железой в виде предшественника - зимогена ( химотрипсиногена), состоящего из единственной цепи длиной 245 аминокислотных остатков. Такая форма необходима, чтобы предотвратить самопереваривание. Гидролиз трипсином ( разрыв пептидной цепи) в двух участках активирует предшественник, приводя к активного а-химотрипсина, в котором три пептидные цепи удерживаются дисульфидными мостиками. [7]
Если к а-химотрипсину, находящемуся в буферном растворе с рН 7 7, прибавить небольшой избыток ДФФ, то 1 моль ингибитора соединится с 1 молем фермента, образуя ферментингибиторный комплекс, который легко кристаллизуется и подвергается диализу и лиофилизации. [8]
Хотя полипептидные цепи а-химотрипсина и субтилизина свернуты совершенно различными способами, аминокислотные остатки, участвующие в катализе ( серии, гистидин и аспарагиновая кислота), располагаются в пространстве одинаково. [9]
С-OR под действием а-химотрипсина был обнаружен ряд интересных кинетических особенностей протекания реакции. [11]
 |
Увеличенное изображение области активного центра пространственной модели а-химотрипси-на (. [12] |
Точнее, цепей, когда а-химотрипсин образуется из предшественника, химотрипсиногена, остатки зимогена 14 - 15 и 147 - 148 теряются. Пять дисульфидных мостиков усиливают связывание первоначальной цепи, так что каждый и указанных сегментов ковалентно связан с другим, а дисульфид-ные мостики, располагающиеся вблизи остатков 57 и 195 активного центра, четко являются факторами, определяющими геометрию каталитического центра. [13]
Протеолитический фермент папайи отличается от а-химотрипсина тем, что в нем цистеин ( или его лабильное производное) входит в состав активного участка. [14]
Протеолитический фермент папаин отличается от а-химотрипсина тем, что в нем цистеин ( или его лабильное производное) входит в состав активного участка. Фермент дезактивируется соединениями, образующими комплексы с группами - SH или реагирующими с ними; активность восстанавливается в результате реакций, которые должны приводить к регенерации SH-групп. [15]
Страницы: 1 2 3 4
