А-химотрипсин
Cтраница 2
Наиболее детально описан механизм действия а-химотрипсина. На рис. 40.9 изображена химическая картина катализа а-химотрипсином, хотя, конечно, конкретные детали механизма зависят от природы рассматриваемой реакции. В гидролизе амида, катализируемом хи-мотрипсином, принимают участие два аминокислотных остатка: гистидин и серии. Имидазольное кольцо гистидина действует как основание, оттягивая на себя протон от гидроксильной группы, которая в это время атакует амидный карбонил. Возможно, уходящая группа субстрата ( амин) протонируется при этом какой-нибудь кислотной группой фермента. Образовавшийся сложно-эфирный карбонил атакуется водой; в результате этого получаются карбоновая кислота и алкоксильный ион, который протонируется катионом имидазолием. [16]
ОН - каталитически активная форма а-химотрипсина. [17]
К раствору миозина добавляют водный раствор а-химотрипсина до конечной концентрации 0 05 мг / мл. Через 15 мин реакцию протеолиза останавливают добавлением 100 мМ раствора фенилметансульфонилхлорида в этиловом спирте до конечной концентрации 2 5 - 10 - 4 М для ингибирования реакции протеолиза. [18]
Известно, что в промышленном препарате а-химотрипсина обычно содержится примесь трипсина, причем оба этих фермента способны катализировать гидролиз этилового эфира N-бепзоил-аргинина. [19]
Не менее поучительно сопоставление сорбционных функций а-химотрипсина и другой сериновой протеазы - трипсина. Единственное различие в первичной структуре полипептидных фрагментов, образующих гидрофобный карман, состоит в том, что в а-химотрипсине остаток 189 - это серии ( см. рис. 9), а в трипсине в соответствующем положении находится отрицательно заряженная аспарагиновая кислота. [20]
Известно, что в промышленном препарате а-химотрипсина обычно содержится примесь трипсина, причем оба этих фермента способны катализировать гидролиз этилового эфира N-бензоил-аргинина. [21]
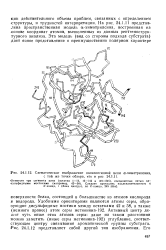 |
Схематическое изображение полипептидной цепи а-химотрипсина, с той же точки обзора, что н 24. [22] |
На рис. 24.1.11 представлена пространственная модель а-химотрипсина, построенная на основе координат атомов, вычисленных из данных рентгенострук-турного анализа. [23]
Какой вывод относительно характера активных участков а-химотрипсина можно сделать на основании того факта, что отрицательно заряженные ингибиторы менее эффективны при подавлении каталитической активности этого фермента, чем нейтральные молекулы со структурой того же типа. [24]
Гидролиз специфических сложноэфирных субстратов, катализируемый а-химотрипсином, протекает при участии имидазоль-ной группы остатка гистидина активного центра фермента, выступающей в качестве общекислотно-общеосновного катализатора. [25]
Показано, что реакция бромкетона с а-химотрипсином при рН 6 0 является бимолекулярной и приводит к образованию ферментативно неактивного белка. Реакция полностью ингиби-руется гидрокоричной кислотой; кроме того, реагент не активен по отношению к химотрипсиногену. Хлоркетои ( при рН 6 0) легко реагирует с а-химотрипсином, однако он мало реакцион-коспособен или вовсе не реагирует с трипсином ( как это обычно имеет место при сопоставлении действия алкилирующих агентов на трипсин и хи. [26]
Химотрипсин 40.9. Гидролиз амида, катализируемый а-химотрипсином. [27]
Под действием ультразвука происходит необратимая инактивация фермента а-химотрипсина. В табл. 7 приведены значения ферментативной активности при различных временах озвучивания раствора фермента. [28]
Экспериментальные данные, полученные при изучений гексамеризации а-химотрипсина. [29]
Под действием ультразвука происходит необратимая инактивация фермента а-химотрипсина. В табл. 7 приведены значения ферментативной активности при различных временах озвучивания раствора фермента. [30]
Страницы: 1 2 3 4