А-электрон
Cтраница 1
 |
Энергетические уровни атома водорода во внешнем магнитном поле. Показаны переходы ЭПР. [1] |
Пусть А-электрон, В - протон; E llzh sBz - l / 2geVBBz; E ( B) l / 2gil - NBz; САвЛн. [2]
Пренебрежение а-электронами; неявно они учитываются, поскольку в значительной степени ответственны за форму молекулы, но их взаимодействием с я-электронами пренебрегают. [3]
Итак, а-электрон это такой электрон, для которого А 0, для я-элек-трона Я1, для б-электрона А. То есть молекула С2 содержит ( кроме двух оболочек гелия, окружающих ядра углерода) 2 электрона, для которых 20и Я0, 2 электрона, для которых 21, А. [4]
Если распределение а-электронов не приводит к появлению дипольного момента, то вычисленная таким образом величина должна совпасть со значением дипольного момента, определяемым путем измерения диэлектрической проницаемости. К сожалению, экспериментальное значение дипольного момента молекулы фульвена неизвестно. Предсказанное направление дипольного момента подтверждается исследованием замещенных фульвенов. [5]
Но число а-электронов в нашем случае больше числа р-электронов, поэтому электроны с а-спином в дважды заполненных МО будут испытывать большее отталкивание от неспаренных а-электронов, чем электроны с р-спином в дважды заполненной МО. Этот эффект должен быть отражен определенными различиями в пространственных функциях а - и р-электронов в заполненных МО. Задавать одну и ту же пространственную часть для а - и р-электронов, значит налагать не вполне оправданное ограничение на волновую функцию, а следовательно, и на пространственное распределение электронов. [6]
Это смещение а-электронов связей С - Н, по-видимому, и обусловливает Положительный индукционный эффект метильной группы. [7]
Обменное взаимодействие а-электронов внутренних оболочек с неспаренным электроном приводит к тому, что орбитали а-электронов должны отличаться от МО р-электронов. Это означает, что а - и р-электроны должны занимать разные МО. [8]
 |
Диаграмма орбитальных энергий для HF. [9] |
Потенциал ионизации а-электронов молекулы HF составляет 19 1 эВ, причем разность между ним и потенциалом ионизации п-электронов ( 3 1 эВ) в рассматриваемой модели обусловлена взаимодействием между 2ра - орбиталью атома фтора и ls - орби-талью атома водорода. [10]
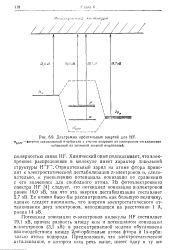 |
Диаграмма орбитальных энергий для HF. [11] |
Потенциал ионизации а-электронов молекулы HF составляет 19 1 эВ, причем разность между ним и потенциалом ионизации я-электронов ( 3 1 эВ) в рассматриваемой модели обусловлена взаимодействием между 2ра - орбиталыо атома фтора и ls - орби-талью атома водорода. [12]
Атомные 5-электроны и соответствующие а-электроны молекул, у которых побочное квантовое число 1 равно 0, о ( бладают только спиновыми моментами. Из этого вытекает, что пара s - или j - электронов не имеет результирующего момента. Эта система, состояние которой описывается в спектроскопии символом ] So, осуществляется у двухвалентных щелочноземельных элементов, а также в цинке, кадмии и ртути. [13]
Эти электроны называют а-электронами ( сигма), а простую ковалент-ную связь а-связью. Следующие электронные пары образуют оболочки с большей энергией, аналогично р-электронам в атомах. Такие электроны называют тг-электронами. [14]
Спин-спиновое взаимодействие, передаваемое а-электрон; ми, уже было представлено схематически на рис. II. [15]
Страницы: 1 2 3 4