Арил-радикал
Cтраница 2
Отсутствие реакционной способности алкоголят-ионов по отношению к арил-радикалам было продемонстрировано также реакцией триарилсульфониевых [10] и триарилиодониевых солей [11] с алкоголятами. В обеих реакциях образуется арил-ради-кал, дающий высокие выходы соответствующих продуктов, и лишь незначительное количество алкилариловых эфиров, возникающих вследствие обычного нуклеофильного замещения. [16]
Считается, что перенос электрона с нуклеофила на арил-радикал [ реакция ( 9) ] предотвращает сочетание п-нитрофе-нил-радикалов с определенными карбанионами. [17]
Хотя это и не цепной механизм, сочетание арил-радикала с одним атомом азота в азидогруппе предполагает, что и азид-ионы должны аналогично реагировать с арил-радикалами. [18]
Стерические препятствия, очевидно, снижают реакционную способность арил-радикалов. Повышенная способность субстратов и нуклеофилов выступать в качестве доноров водорода также благоприятствует возрастанию доли реакции восстановления по сравнению с реакцией замещения. [19]
На рис. 8.1 изображены три возможных основных электронных состояния арил-радикала в зависимости от относительных энергий трех участвующих молекулярных орбиталей. [20]
В средней окружности помещены интермедиаты, принимающие участие в этой реакции - арил-радикалы, анион-радикалы субстрата и продукт замещения. Во внешней окружности находятся продукты реакции. [21]
Димер фениллития претерпевает гомолиз связи фенил - литий, и образующийся при этом арил-радикал атакует другую связь С-Li [ реакция ( 95) ], давая анион-радикал бифенила и катион лития. Указывается также, что эти результаты могут быть объяснены и прямым образованием бифенила при синхронном генерировании двух арил-радикалов и их сочетании с образованием димера. [22]
Реакция ( 42) характерна для субстратов с двумя уходящими группами, промежуточно образующийся арил-радикал которых ведет себя как реакционноспособная частица, вследствие чего общая скорость реакции при этом снижается незначительно. [23]
В цикле развития цепи по реакции ( 21) анион-радикал диссоциирует с образованием арил-радикала и аниона нуклеофугной группы. Если субстрат АгХ представляет собой катион, нуклеофугная группа уходит в виде нейтральной частицы. По реакции ( 22) ар ил-радикал реагирует с нуклеофилом с образованием новой о-связи и нового анион-радикала. Реакция ( 23) представляет собой перенос электрона с анион-радикала на субстрат и завершает последовательность реакций стадии развития цепи. Стадия обрыва цепи зависит от условий реакции. [24]
Степень реализации того или иного пути реакции зависит от природы алкильного остатка R и арил-радикала. Фенил-радикалы с тиофенолят-ионами [65] дают только продукты замещения, а с алкилсульфид-ионами ( алкил метил, этил, н-бутил и трет-бутил) - почти равные количества продуктов замещения и фрагментации. [25]
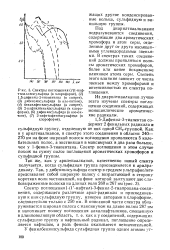 |
Спектры поглощения ( / 1-наф-тилаллилсульфида ( в хлороформе, ( 2 1 5-дифенил - З - тиапентана ( в спирте. [26] |
Спектр поглощения 1 - ( 1 -нафтил) - 3-фенил - 2-тиапропана-соеди - нен ия, содержащего различные арил-радикалы и присоединенную к ним сульфидную группу, измерен авторами в хлороформе, следовательно только с 250 нм. [27]
ВЗМО нуклеофила велика, но все же, согласно примененному выше простому методу, между нуклеофилом и арил-радикалом должны действовать силы притяжения. Как было показано более усложненными методами [22-24], а также при включении в рассмотрение перекрывания во взаимодействии ОЭМО и ВЗМО при очень больших различиях в энергии, притяжение может превратиться в отталкивание. Это одно из объяснений того, почему эти нуклеофилы не реагируют с арил-радикалами. Другим объяснением этого факта служит то, что при сочетании арил-радикала с нуклеофилом сначала должен образоваться анион-радикал с неспаренным электроном на о - МО формирующейся связи; этот анион-радикал затем медленно превращается в более стабильный анион-радикал. [28]
Хотя трег-бутилат-ион широко используется в SRN1 - реакциях в качестве основания, не было обнаружено, чтобы он реагировал с арил-радикалами. Он также представляет собой плохой донор атомов водорода, так как все атомы водорода в нем связаны с первичными атомами углерода. [29]
Интересно, что такие нуклеофилы, как CN, PhSO2 - и NC2 -, которые неактивны в реакциях с арил-радикалами, весьма реакционноспособны по отношению к алифатическому центру. Как обсуждалось выше, различие в активности ароматических и алифатических 5Км1 - систем может быть объяснено медленным переносом электрона с анион-радикала продукта замещения на ароматический субстрат. [30]
Страницы: 1 2 3 4