Белковый компонент
Cтраница 2
Гистоны - белковый компонент нуклеопротеидов. Гистоны регулируют генную активность хроматина. Они содержатся в ядрах клеток высших организмов и состоят из нескольких индивидуальных молекулярных фракций ( HI, Н2А, Н2В, НЗ, Н4), отличающихся содержанием основных аминокислот, элек-трофоретической подвижностью и, вероятно, функционированием в хроматине. [16]
Что касается белкового компонента, то впервые о наличии его в гемоглобине высказался Леман37 в 1852 г. Его мнение поддержали Гоппе-Зейлер 38, Прейер 39 и др. Однако выделить глобин удалось лишь к концу XIX в. Это было сделано одновременно и независимо немецким химиком Шульцем40 и русским химиком Лавровым 41 в 1898 г. Их предшественники в изучении гемоглобина полагали, что в его состав входят кроме гематина и глобина еще какие-то вещества. Очевидно такое представление отразилось и на результатах первых анализов гемоглобина. [17]
Решающее влияние белкового компонента на специфичность каталитического действия хорошо иллюстрируется на примере сравнения каталитических свойств гемоглобина, цитохрома с, каталазы и пероксидазы. Все четыре соединения содержат в качестве простетической группы один и тот же протогем, который связан с белковым компонентом у всех четырех соединений через атом железа. Связывающая группа белкового компонента еще точно не установлена; по мнению некоторых авторов, атом железа связан или с имидазольными или с карбоксильными группами белкового компонента ( см. стр. В пероксидазе белок связан также с кислотными боковыми цепями тема, а в цито-хроме - с винильными группами тема. Эти различия в строении белкового компонента и в характере связей между белком и гемом обусловливают те большие различия в свойствах, которые наблюдаются у гемоглобина, цитохрома с, каталазы и пероксидазы. [18]
Для идентификации белковых компонентов 50S субчастицы, формирующих факторсвязывающий участок, были использованы, в частности, антитела против различных рибосомных белков. [19]
Большое значение белкового компонента флавопротеинов проявляется также в ясно выраженной специфичности этих ферментов. В настоящее время известно, по крайней мере, 10 различных флавопротеинов, которые содержат в качестве простетической группы либо рибофлавинфосфат, либо флавинадениндинуклеотид, но отличаются друг от друга белковыми компонентами. Последний фермент катализирует окисление восстановленных пиридин-нуклеотидда ( см. дальше) в присутствии метиленового синего. Как уже указывалось, различные флавиновые ферменты отличаются друг от друга только по строению своего апофермента, однако до сих пор не установлено, в чем конкретно заключаются их различия. Неизвестно также, каким путем апофер-мент влияет на простетическую группу, обусловливая специфический катализ окисления только определенных типов соединений. [20]
Полипептидные цепи белкового компонента гликопротеидов соединены с углеводным компонентом через гидроксильные группы оксиа. [21]
Казеин является основным белковым компонентом молока. Его получают из снятого молока путем осаждения ( свертывания) обычно с помощью кислот или сычужного фермента. [22]
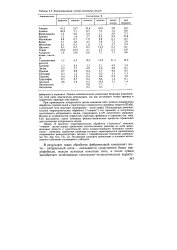 |
Композиционный состав некоторых белков. [23] |
Однако количественное разделение белковых компонентов этой нити практически невозможно, так как отсутствует четкая граница в первичной структуре этих белков. [24]
Гемоглобин в качестве белкового компонента содержит глобин, а небелкового-гем. Видовые различия гемоглобина обусловлены глобином, в то время как гем одинаков у всех видов гемоглобина. [25]
К основным повреждениям белковых компонентов мембран при облучении относится снижение количества SH-групп. [26]
Таким образом, разрушение белкового компонента и освобождение связанных с ним витаминов может быть осуществлено тремя методами: 1) щелочным гидролизом ( омыление), 2) кислотным гидролизом и 3) энзиматическим гидролизом. [27]
Негемовое железо связывается с белковым компонентом, отличающимся от гемсодержащих хромопротеинов. Железо ковалентно связано с атомом серы остатка цистеина в белке. Несмотря на структурные отличия от цито-хромов, негемовые флавопротеины выполняют аналогичную функцию в транспорте электронов благодаря способности переходить из окисленного в восстановленное состояние. [28]
В процессе катаболизма гемоглобина его белковый компонент ( глобин) гидролизуется до аминокислот; железо гема включается в общий пул железа в организме и может вновь использоваться. Вместе с тем свободная от железа порфириновая часть гема необратимо расщепляется до образования желчных пигментов, которые выводятся из организма с содержимым толстого кишечника. Таким образом, гем и продукты его распада не могут реутилизироваться в процессе синтеза порфириновой структуры гемопротеинов. Синтез сложного тетрапиррольного комплекса происходит в организме de novo из простых предшественников. [29]
Так, белок а-керашин, основной белковый компонент копыт, ногтей, волос, шерсти, рогов, панцирей черепах, построен из протяженных а-спиралей. Встречаются у фибриллярных белков и другие, менее распространенные элементы вторичной структуры. Например, полипептидные цепи коллагена, в значительной мере построенные из чередующихся фрагментов строения Gly-X-Pro или Gly-X - llyp ( Hyp - оксипро-лин), образуют левые спирали с параметрами, существенно отличающимися от параметров о-спирали. [30]
Страницы: 1 2 3 4