Переход - молекула - вода
Cтраница 2
Из наружного сосуда вода будет проходить во внутренний и подниматься по трубке, соединенной с внутренним сосудом. Вследствие этого скорость перехода молекул воды из внутреннего сосуда в наружный увеличивается. Наконец, при некоторой высоте h столба раствора в трубке скорости прохождения воды из наружного сосуда во внутренний и из внутреннего в наружный сравняются, и подъем жидкости в трубке прекратится. Давление, которое отвечает такому равновесию, может служить количественной характеристикой явления осмоса. Оно называется осмотическим давлением. Таким образом, осмотическое давление равно тому давлению, которое нужно приложить к раствору, чтобы привести его в равновесие с чистым растворителем, отделенным от него полупроницаемой перепонкой. [16]
 |
Простейший прибор для определения осмотического давления. [17] |
При этом будет повышаться гидростатическое давление, под которым находится раствор во внутреннем сосуде. Вследствие этого скорость перехода молекул воды из внутреннего сосуда в наружный увеличивается. Наконец, при некоторой высоте h столба раствора в трубке скорости прохождения воды из наружного сосуда во внутренний и из внутреннего в наружный сравняются, и подъем жидкости в трубке прекратится. Давление, которое отвечает такому равновесию, может служить количественной характеристикой явления осмоса. Оно называется осмотическим давлением. Таким образом, осмотическое давление равно тому давлению, которое нужно приложить к раствору, чтобы привести его в равновесие с чистым растворителем, отделенным от него полупроницаемой перепонкой. [18]
Подъем уровня в трубке осмометра будет происходить до тех пор, пока скорость перехода молекул воды из стакана через полупроницаемую перегородку в раствор глицерина станет равной скорости перехода воды из раствора в стакан. В начале процесса скорость перехода молекул воды из стакана в сосуд с глицерином будет большей и поэтому уровень жидкости в трубке осмометра сразу повысится, что создаст гидростатическое давление, дальнейший же переход молекул воды из сосуда в стакан приведет к динамическому равновесию. Установившееся в результате осмоса гидростатическое давление является мерой осмотического давления. [19]
Парциальное давление увеличивается по мере перехода молекул воды в паровую фазу. Наконец, увеличение давления прекращается и парциальное давление паров воды становится равным давлению насыщенного пара, и, следовательно, наступает равновесие. [20]
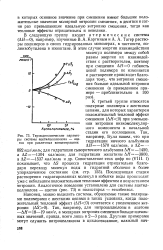 |
Термодинамические параметры системы ацетилцеллюлоза - ацетон при различных концентрациях. [21] |
Так, например, Булл нашел, что при гидратации яичного альбумина АЯ-1570 кал / моль, a AZ - 892 кал / моль; для гидратации сывороточного альбумина ДЯ-1450, a AZ-1304 кал / моль; для гидратации желатины АЯ-3800, a AZ-1537 кал / моль и др. Сопоставление этих цифр по ( VIII. AS процесса гидратации отрицательно благодаря переходу молекул воды в гидратной оболочке в более упорядоченное состояние ( см. стр. Последующая стадия растворения гидратированных молекул в избытке воды происходит уже с небольшим положительным тепловым эффектом и возрастанием энтропии. Аналогичное поведение установлено для системы ацетил-целлюлоза - ацетон ( рис. 73) и полистирол - этилбензол. [22]
Взаимодействие не участвующих в сольватации, но входящих R координационное число молекул воды с ионом не эквивалентно взаимодействию, изменяющему структуру жидкости, так - а: к первое взаимодействие проявляется главным образом после изменения структуры. Кроме того, структурная: сольватация соответствует переходу молекул воды из - связанного как обычно состояния в иное структурное состояние, измененное под влиянием ионов. [23]
 |
Схема прибора для определения осмотического давления. [24] |
Вода, переходящая вследствие осмоса из ванны во внутренний сосуд, вызовет поднятие жидкости по вертикальной трубке. Возникающее при этом во внутреннем сосуде гидростатическое давление увеличит скорость перехода молекул воды в обратном направлении - из внутреннего сосуда во внешний. Когда гидростатическое давление достигнет определенной величины ( при высоте h столба жидкости в трубке), числа молекул воды, диффундирующих в обоих направлениях, становятся одинаковыми - наступает равновесие, и жидкость в трубке больше не поднимается. Давление, которое нужно приложить к раствору, чтобы привести его в равновесие с растворителем, отделенным от него полупроницаемой перегородкой, называется осмотическим давлением. [25]
Адсорбированная монтмориллонитом вода имеет в спектре ПМР дублет и узкую центральную линию. Наличие дублета было интерпретировано Хехтом и Гейсслером [72] как следствие статистических переходов молекул воды между состояниями с разной их ориентацией в льдоподобной структуре, а узкая линия - как результат наличия молекул воды в двух центрах связывания, подвергающихся обмену. [26]
Причина высо кой асимметрии кривой N0 - N0 при N0 - 0 очевидна. Бинарная система с большими отклонениями от идеальной стремится понизить избыточную свободную энергию ( или повысить свою термодинамическую необратимость) путем перехода молекул воды в фазу ионита, где они занимают более низкий энергетический уровень при гидратации противоиона катионита. Приведенные выше факты показывают, что гид-ратированная ионная пара М Л, находящаяся в фазе ионита, представляет для молекул воды еще более низкий энергетический уровень. [27]
При растворении полярных полимеров в полярных растворителях наблюдаются значительные тепловые эффекты растворения, которые определяются в основном взаимодействием макромолекул с растворителем, эффектом гидратации или сольватации. Вместе с тем энтропия смешения вследствие жесткости цепей близка к энтропии смешения низкомолекулярных веществ, а иногда даже уменьшается вследствие перехода молекул воды в упорядоченное состояние в гидратной оболочке. Таким образом, устойчивость растворов ВМС зависит от свойств полимера ( гибкость цепей) и взаимодействия с растворителем. Для полярных ВМС в полярных растворителях определяющим фактором получения и устойчивости растворов является уменьшение ДЯ в результате сольватации; в неполярных - увеличение AS, связанное с гибкостью цепей. [28]
Подъем уровня в трубке осмометра будет происходить до тех пор, пока скорость перехода молекул воды из стакана через полупроницаемую перегородку в раствор глицерина станет равной скорости перехода воды из раствора в стакан. В начале процесса скорость перехода молекул воды из стакана в сосуд с глицерином будет большей и поэтому уровень жидкости в трубке осмометра сразу повысится, что создаст гидростатическое давление, дальнейший же переход молекул воды из сосуда в стакан приведет к динамическому равновесию. Установившееся в результате осмоса гидростатическое давление является мерой осмотического давления. [29]
Наличие структуры оказывает заметную конкуренцию для ионов при их гидратации, и конкретно проявляется в том, что она не позволяет ионам полностью реализовать все свои потенциальные возможности по связыванию воды. Добавление второго электролита, в данном случае деструктурирующей воду хлорной кислоты, приводит к разрушению структуры и как результат этого к дополнительной гидратации катиона Mz, что в свою очередь, естественно, значительно затрудняет переход молекул воды от перхлората к хлорной кислоте. По мере увеличения концентрации электролитов собственная структура воды постепенно исчезает, эффект дополнительной гидратации катиона м2 играет все меньшую роль, и перераспределение воды в сторону хлорной кислоты становится более легким. При 50 собственная структура воды в существенной мере разрушена, гид-ратационная способность катионов реализована полностью. С увеличением концентрации количество свободной воды уменьшается и, следовательно, переход ее к хлорной кислоте затрудняется. [30]
Страницы: 1 2 3