Понижение - температура - затвердевание
Cтраница 1
 |
Шлиф поверхности. [1] |
Понижение температуры затвердевания при увеличении массы растворенного вещества происходит лишь до определенного предела. При некоторой определенной концентра - ции замерзает уже не растворитель, а весь раствор целиком; при этой концентрации температура застывания ниже, чем при всякой иной. Для раствора поваренной соли в воде это получается, если количество соли в воде составляет примерно 30 % по массе. Такой раствор замерзает лишь при - 21 С. [2]
Понижение температуры затвердевания пропорционально количеству примеси только тогда, когда содержание примеси относительно мало. Большинство продажных продуктов содержит сравнительно небольшое количество примесей, и поэтому определение температуры затвердевания является доступным способом быстрого определения качества продукта. [3]
Понижение температуры затвердевания пропорционально количеству примеси только тогда, когда содержание примеси относительно мало. Большинство продажных продуктов содержит сравнительно небольшое количество пр месей и поэтому определение температуры затвердевания является дешевым и доступным способом для быстрого определения качества продукта. [4]
Понижение температуры затвердевания пропорционально количеству примеси только тогда, когда содержание примеси относительно мало. Большинство продажных продуктов содержит сравнительно небольшое количество примесей, и поэтому определение температуры затвердевания является доступным способом быстрого определения качества продукта. [5]
Понижение температуры затвердевания при увеличении количества растворенного вещества происходит лишь до определенного предела. При некоторой определенной концентрации замерзает уже не растворитель, а весь раствор целиком; при этой концентрации температура застывания ниже, чем при всякой иной. Для раствора поваренной соли в воде это получается, если количество соли в воде составляет примерно 30 % по весу. Такой раствор замерзает лишь при - 21 С. [6]
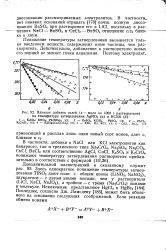 |
Влияние добавок солей ( х - моли на 1000 г растворателя на температуру затвердевания AgNO3 ( а и KCNS ( б. [7] |
Понижение температуры затвердевания вызывается только введением веществ, содержащих иные частицы, чем растворитель. Действительно, добавление к растворителю новых его порций не меняет точки плавления. [8]
Понижение температуры затвердевания при увеличении количества растворенного вещества происходит лишь до определенного предела. При некоторой определенной концентрации замерзает уже не растворитель, а весь раствор целиком; при этой концентрации температура застывания ниже, чем при всякой иной. Для раствора поваренной соли в воде это получается, если количество соли в воде составляет примерно 30 % по весу. Такой раствор замерзает лишь при - 21 С. [9]
 |
Криоскопические постоянные некоторых растворителей. [10] |
Понижение температуры затвердевания растворов имеет важное значение в природе и в технике. Например, выплавка чугуна из железной руды существенно облегчается тем, что температура плавления железа понижается примерно на 250 град благодаря растворению в нем углерода и других элементов. Тугоплавкие окислы в смеси с флюсами ( СаО) плавятся при сравнительно низкой температуре, образуя раствор ( шлак), что позволяет осуществлять непрерывный периодический процесс разливки чугуна и шлака в доменных печах. [11]
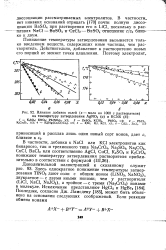 |
Влияние добавок солей ( х - моли на 1000 г растворателя на температуру затвердевания AgNO3 ( а и KCNS ( б. [12] |
Здесь однократное понижение температуры затвердевания T1NO3 дают соли с общим ионом ( LiNO3, NaNO3) v двукратное - с двумя иными ионами, чем у растворителя ( LiCl, NaCl, NaJO3), а тройное - с тремя ( Na2CrO4) ионам в молекуле. Ламсдену [185], может быть объяснено на основании следующих соображений. [13]
Незначительность понижения температуры затвердевания SbBrs указывает на образование твердых растворов. [14]
Страницы: 1 2 3 4