Процесс - открытое испарение
Cтраница 1
Процессы открытого испарения являются одним из важных примеров открытых фазовых процессов. Как известно [3], открытые фазовые процессы представляют собой равновесные процессы фазового превращения, при которых образующаяся фаза непрерывно удаляется из сферы превращения. Теория процессов открытого испарения служит основой для понимания процессов дистилляции многокомпонентных растворов. Кроме того, она дает удобный метод исследования закономерностей фазового равновесия жидкость - пар и связана с изучением процессов ректификации. [1]
 |
Взаимосвязь между поведением дистилляционных линий и расположением проекций изотермо-изобар в концентрационном треугольнике. [2] |
Наряду с процессами открытого испарения можно рассмотреть аналогичный по характеру открытый фазовый процесс равновесной конденсации, в котором происходит превращение пара в жидкость. [3]
Изменение количества жидкости в процессе открытого испарения, ее состав, а также состав равновесного пара закономерно связаны между собой уравнением ( 299), поэтому можно рассчитать условия равновесия между жидкостью и паром по данным о ходе процесса открытого испарения. [4]
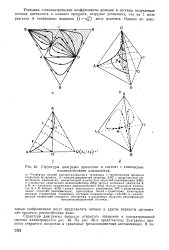 |
Структуры диаграмм процессов в системе с химическим. [5] |
Развертка граней концентрационного тетраэдра с траекториями процесса открытого испарения; б - концентрационный тетраэдр ABC с поверхностью химического равновесия, разделяющей плоскостью областей ректификации BMD и плоскостью химического взаимодействия ABQ чистых исходных реагентов А и В; в - плоскость химического взаимодействия ABQ чистых исходных реагентов А и В: кривая АНВ - линия химического равновесия; ВМ - разделяющая линия областей ректификации; пунктирные линии - траектории химической реакции ( траектории изменения составов псевдоисходных смесей); г - качественные траектории открытого испарения в различных областях ректификации четырехкомпонентной системы. [6]
На рис. 40, а представлены диаграммы процесса открытого испарения в граничных трехкомпонентных составляющих. [7]
Рассмотренные выше уравнения дают необходимую основу для исследования процессов открытого испарения. Один из возможных путей при этом состоит в прямом интегрировании системы ( II. Такой путь может быть использован в конкретных задачах, однако в общем случае он не является вполне удовлетворительным. Зависимость состава пар-а от состава раствора для разных многокомпонентных систем имеет самый разнообразный и зачастую сложный характер. В результате для системы уравнений ( 11 3) может оказаться возможным лишь численное интегрирование. Кроме того, интегрирование в каждом отдельном случае не заменяет исследования общих закономерностей. Отметим также, что практически при разработке новых схем разделения для многокомпонентных смесей часто нет полных данных о зависимости состава пара от состава раствора. [8]
Термодинамическая теория фазовых равновесий между жидкостью и паром и теория процессов открытого испарения в случае систем без химических реакций, как известно [1], тесно связаны между собой и дополняют друг друга. Фазовые равновесия определяют характер протекания процессов открытого испарения, а изучение процессов открытого испарения в свою очередь позволяет установить основные структурные закономерности диаграмм равновесия жидкость - пар. В связи с изложенным в задачу настоящей работы входит термодинамическое рассмотрение равновесия жидкость - пар и процессов открытого испарения в таких формах, которые наиболее полно сочетаются между собой при наличии нескольких химических реакций и которые в то же время позволяют распространить результаты, известные ранее для систем без реакций на случай систем с химическими реакциями. В практическом отношении сформулированная задача связана с исследованиями дистилляционных и ректификационных методов разделения реагирующих веществ и смещения химического равновесия. [9]
В работе проведено термодинамическое рассмотрение равновесия жидкость - пар и процессов открытого испарения в таких формах, которые наиболее полно сочетаются между собой при наличии нескольких химических реакций и которые позволяют распространить известные методы для систем без реакций на случай систем с химическими взаимодействиями. [10]
Согласно приведенной классификации, возможны 16 типов систем, различающихся ходом процессов открытого испарения, реализующихся в 22 вариантах. [11]
В работах [73, 74] рассматривается метод исследования равновесия жидкорть-пар, основанный на изучении процессов открытого испарения. Как указывают авторы, этот метод в определенных случаях может оказаться более целесообразным и простым для применения, чем некоторые иные методы. Преимущества его состоят в том, что исследование равновесия в двойной или многокомпонентной системе можно провести относительно быстро при меньшей затрате исследуемых веществ. В случае п-компонентных систем одновременно определяется направление дистилляционных линий, что может быть полезно при обсуждении ректификационных процессов. Поскольку этот метод мало известен, остановимся на его изложении несколько подробнее. [12]
Изложенные соображения делают поэтому более предпочтительным другой путь, который состоит в выяснении закономерностей процессов открытого испарения с помощью методов качественной теории дифференциальных уравнений. Указанные методы позволяют исследовать важнейшие свойства решений системы ( 11 3), не прибегая к интегрированию самой системы уравнений и основываясь на ограниченном числе качественных характеристик равновесия между жидкостью и паром. [13]
Уравнения ( VI, 69) по форме аналогичны уравнениям ( 11 3) для процессов открытого испарения и выводятся тем же путем. [14]
Аналогия между уравнениями равновесной конденсации и открытого испарения позволяет переносить соответствующим образом результаты, полученные для процессов открытого испарения, на случай процессов конденсации. [15]
Страницы: 1 2 3