Рассмотрение - равновесие
Cтраница 1
Рассмотрение равновесия в растворе, содержащем ион металла и ЭДТА, показывает, что степень комплексообразо-вания зависит от рН раствора. Так, для титрования катионов, образующих малоустойчивые комплексы ( например, кальция и магния), требуется щелочная среда. Наоборот, титрование катионов, образующих более устойчивые комплексы ( например, цинка или никеля), можно успешно провести в умеренно кислой среде. [1]
 |
Изменение концентрации кислоты и окислов азота в абсорбционных башнях. [2] |
Рассмотрение равновесия и кинетики реакций приводит к заключению о необходимости осуществлять переработку нитрозных газов в азотную кислоту при пониженных температурах. Единственной реакцией, на которую понижение температуры влияет отрицательно, является эндотермическая реакция разложения азотистой кислоты. Однако эта реакция и при пониженных температурах не контролирует всего процесса получения азотной кислоты. Все остальные реакции, протекающие при переработке окиси азота в азотную кислоту, являются экзотермическими, и при понижении температуры равновесие их смещается в сторону, благоприятную для образования азотной кислоты. [3]
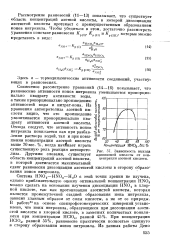 |
Зависимость выхода адишшовой кислоты от концентрации азотной кислоты. [4] |
Рассмотрение равновесий ( 11 - 13) показывает, что существует область концентраций азотной кислоты, в которой диссоциация азотистой кислоты протекает с преимущественным образованием ионов нитрозила. [5]
Рассмотрение равновесия в системах со многими составляющими принимает особенно простую и симметричную форму, если исходить из определений, которые были введены. Рассмотрим общий случай, когда s веществ распределены среди П совместно существующих фаз. [6]
Рассмотрение равновесия между растворяемым веществом и растворителем объясняет существование пересыщенных растворов, в которых формально содержится большее количество растворенного вещества, чем это отвечает определению насыщенного раствора. Отметим, что расположение частиц в кристалле является строго упорядоченным и поэтому для начала кристаллизации необходимо, чтобы 4 - 8 частиц вещества, хаотически перемещающихся, оказались случайно расположенными так, как этого требуют законы - кристаллической структуры. До образования центров кристаллической решетки кристаллизация невозможна, и какое-то время может существовать пересыщенный раствор. [7]
Рассмотрение равновесия и кинетики реакций приводит к заключению о необходимости осуществлять переработку нитрозных газов в азотную кислоту при пониженных температурах. [8]
Рассмотрение равновесия и кинетики реакций приводит к заключению о необходимости осуществлять переработку н и т розных газов в азотную кислоту при пониженных температурах. Единственной реакцией, на которую понижение температуры влияет отрицательно, является эндотермическая реакция разложения азотистой кислоты, которая, однако, и при пониженных температурах не контролирует всего процесса получения азотной кислоты. Все остальные реакции, протекающие при переработке окиси азота в азотную кислоту, являются экзотермическими, и равновесие их смещается в благоприятную для образования азотной кислоты сторону при понижении температуры. Понижение температуры благоприятно сказывается также и на увеличении скорости реакций, в особенности реакции окисления окиси азота, скорость которой решает вопрос об общей продолжительности процесса получения азотной кислоты. Так, понижение температуры процесса поглощения с 40 до 20 позволяет повысить производительность системы в 1 5 раза, а понижение температуры с 40 до 0 -в 2 раза. Понижение температуры процесса поглощения позволяет получать и более концентрированную азотную кислоту. [9]
Рассмотрение равновесия и кинетики разложения апатита фосфорной кислотой приводит к заключению, что оба распространенных режима производства двойного суперфосфата ( ка - Q7 мерный и бескамерный способы) не могут быть признаны полностью оптимальными. [10]
Рассмотрение совокупного равновесия всех возможных реакций, которые протекают на термической и каталитических ступенях процесса, чрезвычайно сложно. [11]
Рассмотрение равновесия сжатой трубы ( стержня) под действием сосредоточенной и распределенной нагрузок представляет значительные трудности. [12]
Рассмотрение равновесия совершенно конкурентной фирмы имеет значение по двум причинам: во-первых, равновесие определяет характер поведения экономического субъекта-производителя и, во-вторых, является основой для понимания рыночного равновесия отдельной отрасли и национальной экономики в целом. [13]
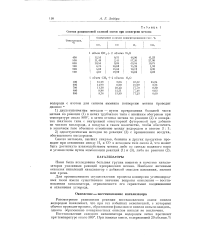 |
Состав равновесной газовой смеси при конверсии метана. [14] |
Рассмотрение равновесия реакции восстановления окиси никеля водородом показывает, что при тех избытках окислителей, с которыми обычно проводят процесс, образования фазы окиси никеля нельзя ожидать, однако образование поверхностных окислов никеля не исключено. [15]
Страницы: 1 2 3 4