Растворение - германий
Cтраница 2
Нами процесс растворения германия изучен при наложении тока и без него. Результаты обоих методов были аналогичны. Скорости растворения рассчитаны по наклону кинетических кривых, выражающих зависимость количества растворенного вещества от продолжительности растворения. [16]
 |
Таблиц 3. Библиографий 7. [17] |
Приведены результаты исследования скорости растворения германия и соединений AJIIBV в кислых растворах хлорного железа. Кинетические закономерности растворения согласуются с представлениями о строении этих веществ и природе химической связи в них. [18]
Для выявления механизма реакции растворения германия необходимо было определить природу дырок, которые в дальнейшем принимают участие в электрохимической реакции. [19]
Различные авторы по-разному представляют механизм растворения германия. [20]
Нами одновременно с изучением кинетики растворения германия в щелочных растворах перекиси водорода было изучено разложение нерекиси водорода в этих условиях. [21]
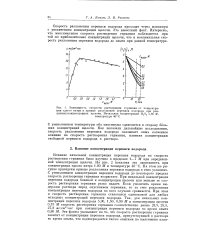 |
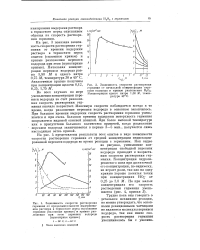
Зависимость скорости растворения германия от концентрации едкого натра и кривые разложения перекиси водорода при различных концентрациях щелочи. Начальная концентрация Н20о 5 80 М. [22] |
Влияние начальной концентрации перекиси водорода на скорость растворения германия было изучено в пределах 1 - 7 М при определенной концентрации щелочи. На рис. 2 показана эта зависимость при концентрации едкого натра 1.00 М и температуре 40 С. На этом же рисунке приведены кривые разложения перекиси водорода в этих условиях. С уменьшением концентрации перекиси водорода до некоторого предела скорость растворения германия возрастает. При начальной концентрации перекиси водорода близкой к концентрации щелочи или меньше ее скорость растворения германия резко падает. [23]
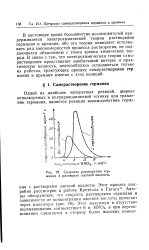 |
Скорость растворения германия в растворах азотной кислоты. [24] |
В настоящее время большинство исследователей придерживается электрохимической теории растворения германия и кремния, ибо эта теория позволяет истолковать ряд закономерностей процесса растворения, не поддающихся объяснению с точки зрения химической теории. В связи с тем, что электрохимическая теория саморастворения представляет наибольший интерес и практическую ценность, целесообразно остановиться только на работах, трактующих процесс саморастворения германия и кремния именно с этих позиций. [25]
Процесс электрохимической обработки ( полировки) основан на вводном растворении германия и кремния. Во время полировки скорость растворения микровыступов превышает скорость растворения микровпадин на поверхности пластин. В результате полировки получают чистую ( V13 - V14 - ro классов чистоты) и ровную неплоскостность 1 - 2 мкм / см на 80 % площади пластины) поверхность пластин. Кроме того, при электрохимической полировке происходит удаление нарушенного слоя, образовавшегося при механической обработке пластин, и вскрытие дефектов кристаллической решетки полупроводников. [26]
Кинетика анодного растворения кремния во многом подобна рассмотренной кинетике растворения германия, но имеет некоторые особенности, связанные с химической устойчивостью его оксида в водных растворах. Если оксидная пленка удалена, кинетика анодного растворения кремния определяется, как и германия, концентрацией дырок на поверхности. Электродные характеристики кремния в электролите отличаются от электродных характеристик германия только количественно. Дырки, необходимые для перевода в раствор атомов кремния, возникают в основном за счет генераций на. Диффузия дырок из объема в этом случае играет существенно меньшую роль. [27]
Все это необходимо учитывать при истолковании механизма электродной реакции растворения германия. [28]
В главе III было показано, что дырки, необходимые для растворения германия, доставляются главным образом путем диффузии из объема полупроводника. [29]
Страницы: 1 2 3 4 5