Металлоорганический реагент
Cтраница 3
Поэтому настоящее решение проблемы создания работоспособного синтетического метода стало возможным лишь после введения в обиход нового поколения металлоорганических реагентов, а именно купратных реагентов - магний - или литийорганических соединений, модифицированных со-шми меди. [31]
Чтобы вывести заключение, необходимо сделать предположение, что скорости таких реакций изменяются симбатпо с изменением основности металлоорганических реагентов при сравнении их в реакциях с одним и тем же субстратом. Однако часть или даже все наблюдаемые эффекты могут быть вызваны и пространственным фактором. В карбанионе Н3С - неразделенная пара электронов должна занимать атомную орбиту, имеющую в значительной степени - характер. Если бы это была чистая А-орбита, то углы менаду связями R-С - R равнялись бы 90 и потому их можно было бы рассматривать как естественные углы между связями в карбаниоие. Увеличение этого угла между связями вследствие отталкивания между группами R способствовало бы образованию неразделенных пар и сделало бы ион менее стойким или более основным. Таким образом, напряжение В [34], которое увеличивается вместе с увеличением разветвления иона, должно было бы увеличить основность анионов. [32]
Поэтому настоящее решение проблемы создания работоспособного синтетического метода стало возможным лишь после введения в обиход нового поколения металлоорганических реагентов, а именно купратных реагентов - магний - или литийорганических соединений, модифицированных солями меди. [33]
По-видимому [56], уменьшение оптической устойчивости диссимметричных литиевых соединений в эфире объясняется увеличением карбанионного и уменьшением ковалентного характера металлоорганического реагента. [34]
Поскольку в двух наиболее общих методах синтеза органоборанов применяют диборан ( при гидроборировании) или активные ( злектронодефицитные) металлоорганические реагенты ( при переметаллировании), то совершенно очевидно, что необходима величайшая осторожность при синтезе несимметричных органоборанов. Требуются низкие температуры, отсутствие потенциальных каталитических реагентов и короткое время реакции. До сих пор нет хорошего общего метода синтеза полностью смешанных триалкилборанов, и причина этого отчасти кроется в протекании обменных реакций. [35]
Поскольку в двух наиболее общих методах синтеза органоборанов применяют диборан ( при гидроборировании) или активные ( электронодефицитные) металлоорганические реагенты ( при переметаллировании), то совершенно очевидно, что необходима величайшая осторожность при синтезе несимметричных органоборанов. Требуются низкие температуры, отсутствие потенциальных каталитических реагентов и короткое время реакции. До сих пор нет хорошего общего метода синтеза полностью смешанных триалкилборанов, и причина этого отчасти кроется в протекании обменных реакций. [36]
Использование хиральных хлорформиатов, например, полученных из / яранс-2 - ( а-кумил) циклогексанола, позволяет провести диастереоселективное присоединение металлоорганических реагентов к 4-метоксипиридину. Введение триизопропилсилильной группы в положение 3 существенно повышает диастереоселективность присоединения. [37]
Обычно для их приготовления используют реакции трех типов: этерификацию, реакцию с органическими хлорсиланами и хлорирование с последующей реакцией с металлоорганическими реагентами. [38]
Алкильные и арильные соединения бора ( или триалкил-и триарилборины, как их иногда называют) можно получить взаимодействием галогенидов бора с реакционноспособными металлоорганическими реагентами. [39]
Ряд энантиофасных дифференцирующих реакций пытались провести в оптически активных растворителях, но во всех реакциях, которые удалось успешно осуществить, использовались металлоорганические реагенты, которые могли образовать комплексы с молекулами оптически активного растворителя. Таким образом, эти реакции, по существу, не отличаются от реакций, в которых участвуют оптически активные реагенты, поскольку с самого начала вносится оптически активное соединение в качестве растворителя. Эта реакция в действительности протекает в бензоле, содержащем () - 2 3-диметоксибутан в эквимолярном количестве по отношению к реактиву Гриньяра, и отсюда, по-видимому, следует, что образуется оптически активный комплекс, который действует уже как реагент. [40]
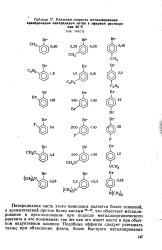 |
Удельная скорость металлнрования. [41] |
Пиперидидная часть этого комплекса является более основной, а ароматический протон более кислым 38 - 40, что облегчает металли-рование в орто-положение при подходе металлоорганического реагента в это положение, так же как это имеет место и при обычном индуктивном влиянии. [42]
Тот же механизм синхронного циклического электронного переноса присущ, по-видимому, и крайне нечувствительным к влиянию заместителей в ароматическом ядре реакциям взаимодействия карбонильных [72, 73] и азометиновых [74] соединений с металлоорганическими реагентами. [43]
 |
Пути синтеза спиртов из беизальдегида. [44] |
Говоря о синтезе каждого конкретного спирта, надо рассмотреть следующие возможные пути: 1) гидролиз галогенидов; 2) восстановление альдегидов, кетонов или карбоновых кислот и их производных; 3) присоединение металлоорганических реагентов к карбонильным соединениям и 4) присоединение воды к алкенам. [45]
Страницы: 1 2 3 4