Реакция - протонирование
Cтраница 2
Для получения металлических комплексов изоцианистоводо родной кислоты используют реакцию протонирования соответствующих цианидов. [16]
По этим причинам сравнение устойчивости карбоний-ионов по данным изучения равновесия реакции протонирования в кислых растворах может быть сделано с такой же степенью достоверности, как и для случая ионизации спиртов, лишь при определении соответствующей функции кислотности, применимой к данным замещенным углеводородам. [17]
Для остановки реакции на стадии присоединения первого электрона необходимо исключить реакцию протонирования анион-радикала. [18]
На основании опытов по влиянию йодистого цетилтриметилам-мония, бромистого гексадецилпиридиния и гексадецилсульфоната натрия на равновесие реакции протонирования большого числа индикаторов с различным знаком заряда ионов ( табл. 12) Гартли [104] предложил так называемое правило знаков, которому подчиняются наблюдаемые сдвиги индикаторного равновесия. [19]
Для необратимых процессов зависимость Е / % от рН наблюдается в тех случаях, когда электрохимической стадии предшествует реакция протонирования органического вещества. [20]
Присоединение карбоний-иона к олефину или к ароматической молекуле приводит к возникновению карбониевого иона, большего по величине, по аналогии с вышеобсуждавшейся реакцией протонирования. [21]
Первая стадия отвечает восстановлению никеля из комплекса и лимитируется диффузией, вторая соответствует восстановлению протонированных лигандов в составе комплекса и лимитируется кинетикой реакции протонирования. [22]
В соответствии с известным механизмом реакции хлор метилирования [ б, 7 ] Б этом случае скорость реакции заметно больше, так как равновесие реакции протонирования формальдегида в хлорсульфоно-вой кислоте более сильно сдвинуто в сторону образования [ СН2ОН ], карбоний катиона, - основной атакующей частицы при реакции хлор-метилирования. [23]
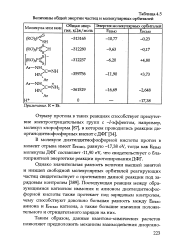 |
Величины общей энергии частиц и молекулярных орбиталей. [24] |
В молекуле диэтилдитиофосфорной кислоты протон в момент отрыва имеет Енсмо, равную - 17 38 eV, тогда как Евзмо молекулы ДФГ составляет - 11 90 eV, что свидетельствует о благоприятной энергетике реакции протонирования ДФГ. [25]
На полярограммах появляются так называемые поверхностные полярографические волны водорода. Реакция протонирования может носить кинетический характер. [26]
Предельная степень протонирования амидов и пептидов сильными кислотами остается невыясненной. Равновесие в реакции протонирования азота, описываемой уравнениями ( 13.13 а) и ( 136), несомненно, сдвинуто влево. Однако убедительно показано, что в определенных условиях происходило протонирование пептидного кислорода, ка. Методами криоскопии [101] и УФ-апектросколии [98, 105, 107] было с очевидностью продемонстрировано практически полное протонирование различных амидов в 100 % - ной серной кислоте. Например, сигнал N-метильной группы N-метилацетамида в серной кислоте представляет собой нормальный дублет. Если бы в системе происходило протонирование по азоту [ см. уравнение ( а) ], то этот сигнал должен был бы быть триплетом или, в случае быстрого обмена с растворителем, синглетом. [27]
Реакции замещения фенольного гидроксила в отличие от спиртового идут в очень жестких условиях, некоторые из них реализуются в промышленности. Также неспецифичны реакции протонирования фенолов, так как электронодонорные свойства атома кислорода из-за mt - сопряжения сильно ослаблены. Тем не менее фенольный кислород вступает в комплексообразование с солями 3 / - металлов. [28]
Если осадок образован анионом слабой кислоты или катионом слабого основания или тем и другим одновременно, то такой осадок в водных растворах подвергается протолизу и его растворимость увеличивается. Протолиз осадков обусловлен реакциями протонирования анионов слабых кислот и гидроксоком-плексообразования катионов, протекающими в водном растворе. Математическое описание количественной зависимости растворимости осадков от сопряженных равновесий, обусловленных многостадийным протолизом, в общем случае очень сложное. [29]
Компоненты реакции (2.1) могут принимать участие н в других реакциях, так называемых конкурирующих ( побочных) по отношению к целевой, интересующей нас реакции. Наиболее типичными побочными реакциями могут быть реакции протонирования лигандов, которые представляют собой слабые кислоты, реакции образования гндроксокомплексов для катионов-комплексообразователей. В реальных многокомпонентных системах элементы присутствуют в нескольких формах, находящихся в равновесии, одна из которых в данных условиях преобладает. [30]
Страницы: 1 2 3 4