Гидрофобное взаимодействие
Cтраница 1
 |
Гидрофобности аминокислотных остатков. [1] |
Гидрофобные взаимодействия имеют определяющее значение для структуры и свойств биологических мГембран и мембранных белков ( гл. [2]
Гидрофобное взаимодействие обусловлено ван-дер-ваальсовыми силами притяжения между неполярными радикалами аминокислотных остатков. У глобулярных белков большая часть гидрофобных групп расположена внутри глобулы белка, а на внешней поверхности находятся преимущественно полярные группы. [3]
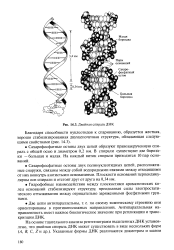 |
Двойная спираль ДНК. [4] |
Гидрофобные взаимодействия между плоскостями ароматических колец оснований стабилизируют структуру, преодолевая силы электростатического отталкивания между отрицательно заряженными фосфатными группами. [5]
Гидрофобное взаимодействие - тип взаимодействия, обусловленный сильным притяжением в воде между неполярными молекулами. [6]
 |
Схема уровней энергий в воде и водном растворе углеводорода ( по Немети и Шераге. [7] |
Гидрофобные взаимодействия являются частным случаем взаимодействий, обусловливающих нерастворимость данного вещества в данном растворителе. Эти взаимодействия определяются как ван-дер-ваальсовыми притяжениями самих неполярных групп, так и взаимодействиями этих групп с водой, которые, как было показано выше, связаны со структурой воды. Главное в теории гидрофобных взаимодействий, согласно Шераге [8] - это представление о том, что число водородных связей, рассчитанное на моль воды, выше вблизи углеводородной молекулы. Гидрофобные взаимодействия приводят к большому отрицательному изменению свободной энергии ( AF) в результате положительного изменения энтропии и малых изменений энтальпии. Энтальпийный член АЯ при гидрофобных взаимодействиях равен нулю для ароматических групп и положителен для алифатических. Движущей силой гидрофобных взаимодействий является изменение энтропии. Следствием термодинамики гидрофобных взаимодействий является то, что с повышением температуры ( до 60 С) эти взаимодействия увеличиваются. Максимум энергии гидрофобных взаимодействий для алифатических боковых цепей находится при 58 С, а для ароматических - около 42 С. [8]
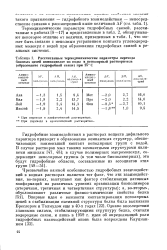 |
Рассчитанные термодинамические параметры перехода боковых цепей аминокислот из воды в ненолярный растворитель ( образование гидрофобной связи при 25 С. [9] |
Гидрофобные взаимодействия в растворах веществ дифильного характера приводят к образованию компактных структур, обеспечивающих наименьший контакт неполярных групп с водой. [10]
Гидрофобные взаимодействия, как уже неоднократно указывалось, играют чрезвычайно важную роль в стабилизации пространственной структуры биополимеров в водных средах. [11]
Гидрофобные взаимодействия, подробно описанные для растворов белковых соединений [46, 47, 50], наблюдали и для других классов соединений. Шриер, Потл и Шерага [53] описывают гидрофобные взаимодействия между молекулами карбоновых кислот в водных растворах. [12]
Гидрофобные взаимодействия не являются новым типом взаимодействий между молекулами. [13]
Гидрофобные взаимодействия проявляются только в водных средах и обусловливаются способностью неполярных молекул образовывать между собой прочные ассоциаты в процессе ми-целлообразования. [14]
Гидрофобные взаимодействия делают реагент менее устойчивым, чем продукт, и есть основание полагать, что сильное увеличение скорости атаки СМ - - ионом вызвано присутствием поверхностно-активного вещества. В результате в мицеллярной системе равновесие смещается в сторону образования продукта. [15]
Страницы: 1 2 3 4 5